|
||||
|
|
63. Хром Хром (Cr) – d-элемент расположенный в 4-м периоде, в VI группе побочной подгруппы. Высшая степень окисления – +6. В соединениях может проявлять степень окисления от + до +6, но наиболее характерными для хрома является степень окисления +3 и +6. В остальных степенях окисления соединения хрома неустойчивы. Физические свойства: хром – серовато-белый металл с характерным металлическим блеском. Природный хром состоит из смеси 5 изотопов: 50, 52, 53, 54, 56. Это самый твердый из всех известных металлов, его плотность 7,2 г/см3. Температура плавления – 1855 °C, температура кипения – 2642 °C. При обычной температуре хром устойчив к воздействию воды и воздуха. Химические свойства: электронная конфигурация: 1s22s22p23s23p63d54s1. В образовании химических связей хрома участвуют не только электроны внешнего 4 уровня, но и электроны предпоследнего уровня – 3d-подуровня. При высокой температуре хром горит в кислороде: 4Cr + 3О2 = 2Cr2О3. Раскаленный хром реагирует с парами воды, вытесняя из нее кислород: 2Cr + 3Н2О = Cr2О3 + 3Н2?. При нагревании реагирует с галогеноводородами, S, N2, P4, C, Si, B: 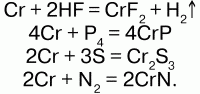 С галогенами реагирует не одинаково: а) со фтором взаимодействует даже на холоде: Cr + 3F2 = CrF6; б) с хлором реагирует при нагревании: 2Cr + 3Cl2 = 2CrCl3. Разбавленная соляная и серная кислоты растворяют хром с выделением водорода, а в холодной азотной он пассивируется. Хром образует три оксида: CrО, Cr2О3 и CrО3. Получение: В чистом виде хром получают двумя способами: 1) металлотермический – восстановление металла из его оксида с помощью другого металла; 2) электролитический – электролиз водного раствора хромовых кислот. При этом одновременно с хромом на катоде выделяется водород. Поэтому получаемый хром содержит включения водорода. Для получения чистого хрома его переплавляют в вакууме. Металлический хром получают алюмотерми-ческим способом (способ Бекетова) из оксида Cr2О3: Cr2О3 + 2Al = Al2О3 + 2Cr. Нахождение в природе: в природе хром встречается только в виде соединений, важнейшим из которых является хромистый железняк FeCrO4 или Fe(CrO)2, из которого путем восстановления углеродом в электропечах получают сплав – феррохром. Используется хром в инструментальной и автомобильной промышленности: хромирование – покрытие хромом других металлов; в металлургии – при производстве легированной стали. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
