|
||||
|
|
Гормоны щитовидной железы, их биосинтез, метаболизм и биологическое действие Часть 2 Глава 3 Эндокринные заболевания и как с ними бороться  Эндокринология – это наука, изучающая анатомию, физиологию и различные патологии желез внутренней секреции: щитовидной железы, половых желез, надпочечников и других эндокринных органов. В эндокринной системе все начинается с действий биологически активных веществ – гормонов. 100 лет назад американский физиолог Э. Старлинг ввел в эндокринологию термин «гормон» (от древнегреч. hormao – «приводить в движение, побуждать»). Самым главным открытием эндокринологии было обнаружение биологически активных веществ, обладающих свойствами гормонов, в головном мозге. Они стимулируют эндокринные железы и координируют их действие, попадая в кровь. Их называют нейрогормонами. Эволюционно древний отдел головного мозга – гипоталамус – «дирижер» оркестра желез внутренней секреции. Гипофиз – маленький придаток мозга. На него действуют нейрогормоны гипоталамуса. Благодаря этим веществам гипофиз выделяет столько гормонов, сколько ему «задают» нейрогормоны, стимулирующие железы внутренней секреции. Эндокринные железы регулируют половые функции организма, обеспечивают адекватную реакцию на стресс, рост и размножение клеток, потребление глюкозы и кислорода тканями и другие физиологические процессы. В 1977 г. единственная Нобелевская премия в области эндокринологии досталась американским исследователям Эндрю Шэлли и Роджеру Гиллемину именно за открытие нейрогормонов. К сегодняшнему дню накопилась солидная информация о генах нейрогормонов, регуляции их активности, воздействии гормонов на рецепторы клеток организма, участии их в разнообразных патологических процессах. Спектр действия гормонов очень широк. Они не только вовлекаются в сложные поведенческие акты, управляя железами внутренней секреции, но и руководят иммунной и сердечно-сосудистой системами. «Отец» учения о стрессе канадский ученый Ганс Селье в XX в. провел множество опытов над животными, подвергая их эмоциональному стрессу. В результате он обнаружил увеличение надпочечников и угасание вилочковой железы (тимуса) – центрального органа иммунной системы. Оказалось, что нейрогормоны, вырабатывающиеся в головном мозге, во время стресса стимулируют кору надпочечников, которая начинает производить стероидные гормоны. Один из них – кортизол – напрямую подавляет иммунную систему. В результате подобных исследований возникла новая медико-биологическая дисциплина – нейроиммуноэндокринология. Она изучает взаимодействие нервной, иммунной и эндокринной систем. Например, при возникновении инфекционного заболевания они объединяются в одну функциональную систему. У заболевшего вирусной или бактериальной инфекцией происходит активация иммунной системы. Ее клетки вырабатывают вещества, настроенные на уничтожение источника возбудителя болезни. Среди этих веществ есть белки, называемые цитокинами. С кровью они доставляются в клетки мозга. В свою очередь, эти клетки вырабатывают нейрогормоны. Именно цитокины координируют выработку различных типов клеток. Один из нейрогормонов – кортиколиберин – через гипофиз запускает выработку кортизола корой надпочечников. Кортизол предотвращает чрезмерную активацию иммунной системы, которая может привести к поражению собственных тканей. Тот же нейрогормон – кортиколиберин – провоцирует развитие депрессивных состояний. У людей, страдающих депрессией, в спинномозговой жидкости содержание кортиколиберина повышено. Сегодня наука о гормонах располагает достаточно большим объемом информации. Расширяется применение нейрогормонов в клинической практике. Например, нейрогормон соматостатин угнетает секрецию гормона роста. Его синтетические аналоги имеют перспективу применения в клинике аутоиммунных заболеваний (таких, как артрит, ревматизм). Вещества – антагонисты кортиколиберина могут лечить депрессивные состояния. Эндокринная система контролируется мозгом. Поражения нейрогормональной регуляции системы (эндокринного звена) могут быть первичными, самостоятельными, идиопатическими или вторичными, сопутствующими, симптоматическими, возникающими при каких-либо инфекционных, токсических, травматических, опухолевых, врожденных патологиях и в результате поражения других систем, органов и тканей организма. Сбои гормональной регуляции в организме имеют разные пути: 1) в результате расстройства высшей нейрогормональной (гипоталамо-гипофизарной) регуляции деятельности той или иной эндокринной железы; 2) из-за прямого поражения при инфекции, интоксикации, травме, опухоли одной или нескольких эндокринных желез; 3) как проявление недостаточности субстрата или ферментной стимуляции гормонообразования в определенных железах; 4) в результате нарушения доставки тех или иных гормонов к месту их действия вследствие их разрушения, связывания, инактивации; 5) вследствие изменения условий действия гормонов (например, электролитной среды тканей); 6) в результате изменения реактивности к действию тех или других гормонов соответствующих периферических органов-«мишеней». Нарушение деятельности любого звена нейрогормональной регулирующей системы, возникшее любым путем, неизбежно влечет за собой реакцию и изменения других звеньев регулирующей системы. Этому сопутствуют линия побочных патологических процессов и линия возникновения приспособительно-компенсаторных реакций. В патогенезе многих заболеваний нервной системы, внутренних органов, опорно-двигательного аппарата, кожи имеет место расстройство гормонального регулирования. Необходимость дополнительной гормонотерапии при заболеваниях требует от врача разумной осмотрительности. Заболевания гипоталамо-гипофизарной системы и борьба с ними Гипофиз вплотную прилежит к основанию головного мозга и состоит из передней, средней и задней долей, каждая из которых наделена особыми функциями. В передней доле гипофиза вырабатываются различные гормоны. В настоящее время в чистом виде из них выделены шесть тропных: адренокортикотропный (АКТГ), тиреотропный (ТТГ), фолликулостимулирующий (ФСГ), лютеинизирующий (ЛГ), лактотропный (ЛТГ) или пролактин, соматотропный гормон, стимулирующий процессы роста. Средний (промежуточный) сегмент гипофиза является узкой пластинкой многослойного эпителия. В нем происходит интенсивное образование коллоидоподобного секрета – фолликулов с гликопротеидным содержимым. Задняя доля гипофиза состоит преимущественно из нервных клеток (питуицитов) и секретирует гормоны вазопрессин (антидиуретический гормон) и окситоцин. Биологическая роль гормонов гипофиза в организмеТиреотропный гормон (ТТГ) – гликопротеид. В состав его молекулы входит 200–300 аминокислотных остатков и углеводы (манноза, глюкозамин, фруктоза). Тиреотропный гормон активирует щитовидную железу. Гонадотропные гормоны: фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) близки между собой по химическому составу и физико-химическим свойствам и совместными действиями регулируют все половые функции. Лактотропный гормон (пролактин) воздействует на молочные железы, активизируя образование молока. Адренокортикотропный гормон (АКТГ) оказывает влияние на кору надпочечников, мобилизует жиры из жировых депо, усиливает гидролиз нейтральных жиров, способствует окислению жиров, усиливает кетогенез, понижает дыхательный коэффициент, способствует накоплению гликогена в мышцах, снижает содержание аминокислот в кровяной плазме и увеличивает их поступление в мышечные ткани. Соматотропный гормон (СТГ) – гормон роста, оказывающий общее действие на организм. Разрушение или недоразвитие гипофиза ослабляет и даже прекращает процесс роста. Избыточная функция передней доли гипофиза приводит к чрезмерному усилению роста (гигантизму) или к поражению некоторых частей тела (акромегалии – неравномерному увеличению роста). СТГ влияет на развитие и рост скелета, активизируя процессы хондрогенеза и остеогенеза. СТГ стимулирует синтез и обмен кислых мукополисахаридов, особенно повышая образование хондроитинсерной кислоты. В условиях гипофизэктомии прекращается пролиферация эпифизарных хрящей и, следовательно, рост костей останавливается. Под влиянием СТГ ширина эпифизарных хрящевых прослоек вновь увеличивается. СТГ «отвечает» за жировой обмен, оказывает существенное влияние на обмен углеводов. Гипофизэктомия сопровождается понижением уровня сахара в крови и повышением чувствительности организма к инсулину. Меланоцитостимулирующий гормон, или интермедин, влияет на состояние пигментных клеток. Предполагается, что этот гормон повышает активность палочек и колбочек сетчатки и улучшает адаптацию глаз к темноте. Если заболевание гипофиза (например, при опухолях) сопровождается усилением продукции меланоцитостимулирующего гормона, то возрастает концентрация его в крови и моче, что и случается при аддисоновой болезни, болезни Иценко – Кушинга, при ревматоидном артрите, при циррозе печени, астматическом статусе, тяжелом гастроэнтерите. Нейрогипофизарные гормоны – вазопрессин (антидиуретический, АДГ) и окситоцин – вырабатываются нейросекреторными клетками переднего гипоталамуса и, накопившись в задней доле гипофиза, выделяются в ток крови. По химической природе вазопрессин и окситоцин принадлежат к октапептидам. Их молекула содержит восемь аминокислот. Вазопрессин и окситоцин инактивируются в почках, печени, в крови. Антидиуретический гормон (АДГ, вазопрессин) непосредственно действует на мочеотделение, а именно усиливает реабсорбцию воды, протекающей по нефронам. При недостаточности задней доли гипофиза реаб-сорбция уменьшается, вследствие чего развивается полиурия и обезвоживание организма. Для повышения артериального давления требуется более высокое (больше физиологического) количество вазопрессина, чем для его эффективного влияния на мочеотделение. Секреция АДГ увеличивается в условиях возрастания осмотического давления крови и уменьшения ее объема, будучи рефлекторной реакцией на раздражение осморецепторов, главным образом тех, которые локализуются в стенке сонных артерий, аорты и левого предсердия. Болевые воздействия, эмоциональные потрясения, никотин, морфин, эфир увеличивают секрецию АДГ. В связи с этим существует опасность водной интоксикации организма. Окситоцин, наряду с другими регулирующими механизмами, оказывает сильное влияние на родовую деятельность. Окситоцин участвует в регуляции лактации, усиливая сокращение миоэпителиальных клеток альвеол молочных желез, активируя молокоотдачу. Рефлекс, вызывающий выделение молока, начинается раздражением рецепторов, залегающих в сосках. Поэтому акт сосания является специфическим возбудителем секреции окситоцина. При этом окситоцин вызывает отдачу лишь готового молока. Образование его клетками молочной железы стимулируется ЛТГ передней доли гипофиза. Деятельность гипофиза осуществляется в содружестве с гипоталамусом. Гипоталамус вырабатывает аденогипофизотропные гормоны, которые активизируют или угнетают секрецию гормонов передней доли гипофиза. Гипоталамо-гипофизная система, контролируя функции желез внутренней секреции, испытывает в то же время сильные влияния со стороны последних. Особенно важна зависимость гипоталамуса от щитовидной железы. Для нормальной деятельности гипоталамуса необходим соответствующий уровень тиреоидных гормонов в циркулирующей крови. Гипоталамус является одной из основных точек приложения кортизола и половых гормонов. Поражения гипоталамо-гипофизарной системыСистематизация различных форм заболевания гипоталамо-гипофизарной системы до сих пор представляет значительные трудности. В. Шрейбер (1963) выделял следующую симптоматологию: 1) нейровегетативную; 2) метаболическую; 3) психическую; 4) эндокринную. Позднее получила распространение классификация мозговых поражений, представленная Н. Гращенковым (1963), различающая такие формы, как: 1) нейроэндокринная форма, включающая обменно-эндокринные расстройства: жирового, водно-солевого обмена, синдромы гипер– и гипотиреозов, прогрессирующего пучеглазия и другие проявления патологии обменных процессов и дисфункций нейроэндокринной системы; 2) нейротрофическая форма, характеризующаяся разнообразными нервными дистрофиями: болезненное уплотнение кожи, нервно-мышечное воспаление, кожно-мышечное воспаление, хронический язвенный процесс и т. д. Эти изменения нередко сочетаются с обменно-эндокринными расстройствами и вегетативно-сосудистыми кризами; 3) вегетативно-сосудистая форма, основными признаками которой являются выраженные в различной степени нарушения сосудодвигательной иннервации, яркие вегетативно-сосудистые расстройства, сопровождающиеся кризами, мигренью, изменением уровня артериального давления. В. Г. Вогралик (1964) разграничил нарушения регуляции висцеральных функций на: 1) первичные диэнцефало висцеропатии. К первичным диэнцефало висцеропатиям он отнес: а) диэнцефало кортикальные синдромы; б) диэнцефало вегетативно-висцеральные синдромы; в) диэнцефало гипофизарно-эндокринные синдромы; 2) вторичные (симптоматические) расстройства нейрогормональной регуляции. В свете этих всех классификаций ученые выделили гипоталамо-аденогипофизарные и гипоталамо-нейрогипофизарные заболевания исходя из определенной обособленности гипоталамических ядер, имеющих отношение к функциям передней и задней доли гипофиза. В гипоталамо-аденогипофизарной системе регуляция эндокринных желез осуществляется по уникальному пути: гипоталамические центры, расположенные в середине, продуцируют аденогипофизарные гормоны, поступающие в кровь портальных вен, а оттуда направляются к аденогипофизу. Трансгипофизарная функция осуществляется посредством тропных гормонов аденогипофиза, когда происходит дальнейшая реализация регуляторных влияний нервной системы на периферические эндокринные железы. В гипоталамо-нейрогипофизарной системе продукты нейронов поступают в заднюю долю гипофиза, а затем в общий круг кровообращения. Нейроэндокринные заболевания, в которых имеет значение поражение диэнцефальной области, можно разделить на множество видов. 1. Гипоталамо-аденогипофизарные заболевания: 1) гипопитуитарные синдромы; 2) патология роста (акромегалия, гигантизм, нанизм); 3) болезнь Иценко – Кушинга; 4) гипоталамическое (нейроэндокринное) ожирение; 5) синдром Барракер – Симонса; 6) болезнь Деркума; 7) адипозо-генитальная дистрофия; 8) синдром Лауренс – Мун – Барде – Бидля; 9) гипермускулярная липодистрофия; 10) синдром Морганьи – Морель – Стюарта. 2. Гипоталамонейрогипофизарные заболевания: 1) несахарный диабет; 2) гипергидропексический синдром (синдром Пархона). Гипопитуитарные синдромы Сбой тропных функций гипофиза с гипофункцией других периферических эндокринных желез наступает вследствие поражения гипофиза и гипоталамуса. При этом возникают гипопитуитарные синдромы – синдромы разрушения гормонопродуцирующих клеток передней доли гипофиза. 1. Синдромы гипопитуитаризма из-за выпадения аденогипофизарных функций. Проявление у детей: 1) патология роста; 2) патология полового развития; 3) аденогипофизарная дистрофия с ожирением либо истощением. Проявление у взрослых: 1) острые поражения аденогипофиза (некроз, инфаркт) с быстрым смертельным исходом, вследствие чего явления гипопитуитаризма не успевают развиться; 2) пангипопитуитаризм – патологическое состояние развивающееся вследствие поражения гипофиза и гипоталамуса (гипофизарная кахексия, синдром Шиена, синдром Килина); 3) изолированное выпадение тропных функций. 2. Синдромы гипопитуитаризма с преимущественным выпадением антидиуретической функции нейрогипофиза проявляются обменно-эндокринными расстройствами. Гипопитуитаризму могут предшествовать ишемический инфаркт, некроз, кровоизлияние в аденогипофиз при кровотечениях, тромбозах в родовом и послеродовом периодах, травмы черепа, различные инфекции и интоксикации. Разрушение гипофиза может быть связано с туберкулезными, склеротическими или опухолевыми его поражениями, саркоидозом, а также образованием в гипофизе паразитарных кист. Многочисленные ошибки случаются при неправильной оценке характерных для гипопитуитарных синдромов обменно-трофических и эндокринных расстройств. Бледность из-за уменьшения пигментации кожи в сочетании со снижением числа эритроцитов служит основанием для диагноза малокровия; изменения в нейропсихическом статусе заставляют предположить наличие неврастении; нарушения функций половых и щитовидных желез. Но важным диагностическим признаком является необычная реакция больных на введение некоторых гормональных препаратов. Прием тиреоидина нередко сопровождается побочными явлениями с повышением температуры тела до 38–40 °C, а при введении инсулина возможны тяжелые гипогликемии. Гипопитуитарные синдромы, имеющие в своей основе органическую природу, следует дифференцировать с психогенной анорексией. Развитие заболевания может явиться следствием сексуальных конфликтов и стремлением сознательного ограничения питания с целью похудения. В дальнейшем формируется отвращение к еде. При анорексии, связанной с психогенными факторами, отвращение к пище проявляется в начале болезни, а со временем болезнь протекает со всеми признаками гипопитуитарного синдрома, т. е. снижается деятельность щитовидной железы, надпочечников. Но для психогенной анорексии характерно резкое исхудание при удовлетворительном состоянии с сохранением физических сил. И важным диагностическим фактором является сохранение менструального цикла и отсутствие обратного развития вторичных половых признаков. Существует синдром Килина, похожий на нервную анорексию. Этот синдром развивается у девушек 16–25 лет, как и нервная анорексия, в связи с предшествующими конфликтными ситуациями. Налицо признаки нервно-психических и гормонально-обменных нарушений. Истеричность поведения, прогрессирующее исхудание, потеря аппетита, нарушение функций желудочно-кишечного тракта сопровождаются нарушением менструального цикла, признаками гипотиреоза, надпочечниковой недостаточности, несахарного мочеизнурения. Следовательно, расстроена гипоталамическая регуляция. Это стертые формы гипопитуитаризма. Чем раньше они будут диагностированы, тем своевременнее начнется лечение во избежание возможности тяжелых осложнений, которые могут спровоцироваться неожиданными стрессовыми воздействиями. При таких формах заболевания больных одолевает слабость, наблюдаются быстрая утомляемость, плохой аппетит, частые обморочные состояния. Факторы, предшествующие этому, – в основном трудные роды или аборт. Эндокринный дисбаланс проявляется в нарушении менструального цикла, артериальной гипотонии, вегетативно-трофическими расстройствами (раннее поседение, «разрушение» зубов, чувство зябкости, снижение интеллектуальных способностей). Если таким больным посчастливится забеременеть, то отмечается улучшение их состояния. Лечение проводится в соответствии с характером патологического процесса, приведшего к заболеванию. Если имеют место опухоль, сифилис или энцефалит, то рекомендуется лучевая терапия. В других случаях назначается стимулирующая терапия: применение кортизона по 25 мг, дезоксикортикотерона по 0,5–2 мг в день, тестостерона пропионата по 10–25 мг 2–3 раза в неделю, тиреоидина по 0,05 – 0,03 г 2 раза в день (5 дней в неделю); женщинам – диэтилстильбэстрола по 1 мг. Очень эффективен курс лечения профизоном (состоящий из 30 инъекций), проводимый в течение недели. Рекомендуются препараты общеукрепляющего и общетонизирующего действия, улучшающие функцию кроветворения (железосодержащие вещества, витамин В12, фолиевая кислота). Для повышения аппетита нельзя применять инсулин, так как даже его маленькое количество может приводить к резкому снижению глюкозы в крови. При снижение функции щитовидной железы применяют тиреоидин. Менструальный цикл восстанавливают с помощью половых гормонов, препаратов анаболического действия – метандростенола, ретаболила и др. Если наступает коматозное или прекоматозное гипопитуитарное состояние, оказывают помощь массивной кортикостероидной терапией в виде капельной инфузии по 100–300 мг в сутки гидрокортизона (по 50 мг каждые 4–6 ч.). Дополнительно назначают 25 %-ный раствор глюкозы по 200–300 мг внутривенно, кордиамин, строфантин. При этом больного обязательно согревают. Тяжесть и давность патологического процесса определяют эффективность терапии. Необратимые структурные нарушения в аденогипофизе и ядрах гипоталамуса позволяют достичь лишь внешнего эффекта. Только неоднократные курсы гормональной и общестимулирующей терапии приводят к стабильному улучшению состояния организма. Гипофизарная карликовость Гипофизарная карликовость (гипофизарный нанизм) – заболевание, выражающееся в задержке роста и полового развития в результате недостаточного образования соматотропного и гонадотропных гормонов в передней доле гипофиза. Рост взрослого мужчины ниже 130 см и взрослой женщины ниже 120 см считается карликовым. Выяснить происхождение болезни очень проблематично. Иногда это опухолевое, воспалительное или травматическое поражение гипофиза или центральной нервной системы. В детском возрасте легко нарушить нормальную гипоталамо-гипофизарную систему и этим обусловить задержку роста и развития. В этом плане отрицательно воздействуют на организм психические и физические травмы, а в период внутриутробного развития – инфекционные заболевания матери. Не врожденный, а «приобретенный» карликовый рост возникает у детей, перенесших родовую черепно-мозговую травму (затяжные роды, обвитие пуповиной, рождение плода в состоянии асфиксии). Питание, скудное в отношении белков и витаминов, часто провоцирует нарушение роста. Наследственность (карликовость родственников, пожилой возраст родителей, просто низкий рост) также сказывается задержкой роста. Пропорционально его задержке запаздывает окостенение хрящей, и поэтому отмечается слабое развитие скелетной мускулатуры и подкожной жировой клетчатки. Гипофизарный нанизм может сочетаться с несахарным мочеизнурением, если происходит атрофия передней и задней доли гипофиза вследствие сдавливания опухолевым процессом. Суть болезни заключается в отставании роста по отношению с возрастной нормой. Мышечная система развивается слабо. Внутренние органы увеличиваются соответственно росту. Задерживается развитие половых органов и вторичных половых признаков как у женщин, так и у мужчин. Половое влечение не формируется. При вроде бы нормальном психическом развитии в поведении проявляется инфантильность, отмечается снижение памяти и трудоспособности. Для выяснения причины нарушения роста большое значение имеют тщательно собранные данные. Можно установить хронологическое совпадение появления задержки роста с нервным заболеванием или с перенесенной инфекцией. Врожденный характер заболевания подчеркивают пороки («заячья губа», приросшие мочки ушей, шестипалость). Гипофизарный нанизм следует отделять от иных форм нарушения роста и физического развития. Тиреогенный нанизм (кретинизм) характеризуется непропорциональной задержкой роста, психической отсталостью и эмоциональной тупостью, вялостью, сонливостью. Внешность сразу выдает наличие заболевания: крупная голова с низким лбом, широко расставленные глаза, одутловатое бледное лицо, короткая шея, не помещающийся в ротовой полости утолщенный отечный язык. Болезнь Дауна – врожденная патология роста, умственная отсталость, узкий косой разрез глаз, маленькая голова, бессмысленное выражение лица, безосновательная веселость, вялые слабые мышцы. Слегка задерживается окостенение. Хондродистрофия – патология роста, связанная с нарушением энхондрального окостенения. Рост конечностей отстает от роста туловища. Плечевые и бедренные кости укорочены. Кисти рук и стопы маленькие широкие, но с короткими пальцами. Голова относительно туловища велика. Нормальное половое развитие. Соматогенная дистрофия – задержка роста в результате длительной изнуряющей болезни. Отличается истощением, анемизацией и другими расстройствами. Лечение гипофизарного нанизма. Следует установить основную причину заболевания. При опухолевом или воспалительном поражении гипоталамо-гипофизарной системы уместно лучевое, хирургическое или противовоспалительное лечение. Необходимо устранить очаг хронической интоксикации (туберкулезной, гнойной и т. д.). Введением гормона роста лечат гипофизарный нанизм. В комплексе используются гормональные и витаминные препараты, нормализующие обменные процессы и повышающие реактивность организма. Анаболическое действие инсулина часто используется для стимуляции роста и прибавки веса. Высокой анаболической активностью обладают андрогенные стероиды, но их следует применять для лечения карликовости с особой осторожностью из-за их побочного вирилизирующего действия. Метандростенолон может вызвать нарушение оттока желчи из мелких печеночных протоков вплоть до развития своеобразной механической желтухи. Эти препараты использовали ранее для лечения карликовости больных детского возраста. Сегодня от них отказались из-за побочных действий. В настоящее время для лечения карликовости предпочтительно применение феноболина и ретаболила. Дозы препаратов определяют из расчета 1 мг/кг раз в месяц. Их можно чередовать с 5 %-ным масляным раствором андростендиола дипропионата по 1 мг/кг через день. При гипотиреозе целесообразно применение тиреоидина. Наряду с гормональным лечением необходимо проведение общеукрепляющей терапии, употребление больным препаратов кальция, железа, фосфора, комплекса витаминов. Стимуляция роста – единственная задача гормональной терапии карликовой гипофизарности. Преждевременное введение гонадотропинов (до успешной стимуляции роста) может вызвать нежелательное ускорение закрытия зон роста и стать причиной психосексуальных расстройств. Гигантизм Гигантизм – заболевание, характеризующееся усиленным ростом, не соответствующим возрасту, полу и национальности, развивающееся вследствие избыточной продукции соматотропного гормона гипофиза. Чаще гигантизмом страдают из-за наследственной предрасположенности. Роковую роль могут сыграть черепно-мозговые травмы, инфекционно-токсические воздействия (перенесенные в детстве энцефалит, тяжелые детские инфекции), опухолевые, инфекционно-токсические поражения с гиперплазией ацидофильных клеток передней доли гипофиза. Гигантизм характеризуется многими патоморфологическими изменениями. Скелет при этом заболевании более пропорционален и гармоничен. Но в костном аппарате расширены зоны эпифизарных хрящей; в трубчатых костях отмечаются гиперостозы и образование новых костномозговых полостей с явлением остеопороза, расстройства энхондрального костеобразования в диафизах и резкое расширение периоста. Внутренние паренхиматозные органы спланхномегаличны. При этом заболевании наблюдаются утолщение эпидермиса и атрофические нарушения. Гигантизм – редкая эндокринная патология, поражающая в основном мужчин. Ускорение роста происходит в период полового созревания между 12 и 15 годами. Прибавка роста может то замедляться, то ускоряться периодами. В это время увеличиваются внутренние органы и растут усиленным темпом мягкие ткани, гипопластически и атрофически изменяются половые железы. Половые органы развиваются медленнее общего роста организма. У женщин при гигантизме месячные либо отсутствуют, либо проходят беспорядочными циклами, молочные железы остаются недоразвитыми. В результате развивается бесплодие. Периферические эндокринные железы патологически изменены: в щитовидной железе выявляются узлы, реже сопровождающиеся явлениями гипертиреоза. Иногда встречается сахарный диабет. Но несахарный диабет развивается обязательно. Гигантизм сопровождается психическими нарушениями: снижением интеллектуальных способностей (до умственной отсталости), раздражительностью, инфантильностью, бессонницей. Как следствие, образуются ипохондрические и депрессивные синдромы из-за осознания больными своей ущербности и повышенного внимания окружающих к их личности. Вследствие усиленного роста костей и наличия опухоли нарушаются стенки турецкого седла в черепе, происходит сужение периферических полей зрения. От паспортного возраста значительно отличается в сторону старения костный возраст. В исключительных случаях гигантский рост не осложняется патологическими нарушениями всего организма. Присутствует детородная функция, трудоспособные гиганты иногда доживают до преклонного возраста. Но в подавляющем большинстве случаев они погибают в молодости от интеркурентных заболеваний вследствие снижения иммунитета. Диагностировать сразу гигантизм сложно. Порой ускоренный рост подростка носит конституционально-наследственный характер. Но если есть жалобы на головные боли и заметно диспропорциональное (по акромегалическому типу) развитие отдельных частей тела (превалирует увеличение размеров кистей и стоп, прогрессирующее укрупнение черт лица, утолщение языка), то можно не сомневаться в гигантизме, обусловленном патологией гипофиза. Лечение гигантизма направляется на снижение продукции соматотропного гормона, на торможение роста опухоли (лучевая терапия межуточно-гипофизарной области), на нормализацию нарушенных функций других эндокринных желез и внутренних органов. Хирургические удаление опухоли производится при быстром ее увеличении, прогрессирующем снижении зрения и неэффективности лучевой терапии. При отсутствии опухоли разрешается применение половых гормонов и их синтетических аналогов. Они влияют на ускорение окостенения эпифизарных хрящей и закрытие зон роста. Девушкам предлагается вводить эстрогены в дозе 20–30 мг в течение двадцатидневного курса, после чего вводят по 10 мг прогестерона в течение 3 дней. После десятидневного перерыва курс повторяют. Цикл лечения проводится на протяжении полугода и даже года. Юношам вводят тестостерон по 1200 – 200 мг в течение месяца или тестостерона пропионат по 25 мг 2–3 раза в неделю до окостенения эпифизарных хрящей и полового созревания. Акромегалия Акромегалия – заболевание, характеризующееся патологической формой роста костей, мягких тканей и внутренних органов, обусловленное усиленной продукцией гормона роста передней доли гипофиза. Обычно заболевание вызывается эозинофильной аденомой гипофиза либо гиперплазией его ацидофильных клеток, усиленно продуцирующих гормон роста. Но при отсутствии эозинофильной аденомы причиной акромегалии могут быть злокачественные новообразования левой лобной доли, эпидермический энцефалит, кисты большой цистерны после перенесенных инфекционных заболеваний и травм черепа, при врожденном или приобретенном сифилисе. Правда, случившиеся травмы не становятся причинами патологии роста, а лишь являются провоцирующими моментами для проявления заболевания. Гиперпродукция гормона у взрослых людей с законченным формированием скелета вызывает периостальный рост костей, вследствие чего они деформируются и утолщаются. У 50 % больных акромегалией нарушена толерантность к глюкозе, и поэтому развивается сопутствующий сахарный диабет. В сыворотке крови определяется увеличенное содержание инсулина. Ряд других биохимических показателей у больных акромегалией зависит от патологического процесса. Если он прогрессирует, то в крови повышается содержание кальция, так как повышается функция околощитовидных желез. Наряду с деминерализацией костей повышается содержание неорганического фосфора в сыворотке крови. В изменении внешности больных акромегалией превалирует укрупнение черт лица и увеличение конечностей (кистей и стоп). Утолщаются кости черепа, выступают надбровные и скуловые дуги, затылочный бугор. Челюсти выдаются вперед, разрастаются мягкие ткани лица, увеличиваясь и утолщаясь. За счет гипертрофированных сосочков увеличивается язык. Ему становится тесно во рту, он давит на зубы. Голосовые связки утолщаются, низкий и грубый звук речи делается смазанным и неясным. Кожа становится толстой и дряблой с расширенными сальными и потовыми железами, с выделением пота неприятного запаха. Кожа гиперпигментирована или, наоборот, депигментирована. Нарушается оволосение: некоторые лысеют или, наоборот, обрастают волосами на лице и туловище. Последнее особенно характерно для женщин. В начале заболевания мышечная система гипертрофируется, а в дальнейшем происходит мышечная атрофия с прогрессирующей слабостью. Внутренние органы также изменяются: повышается артериальное давление, нарушается функция сердечно-сосудистой системы, увеличиваются печень, желудок, удлиняется кишечник. У женщин гипертрофируются половые железы. Повышается внутричерепное давление, развиваются невриты, радикулиты. В офтальмологическом статусе симптомы повышения внутричерепного давления вызывают застойные явления, мелкие кровоизлияния в глазных яблоках. Выпадает периферическое поле зрения, порой выключается восприятие определенного цвета. Наряду с прогрессированием остеопороза расширяются позвонки позвоночника, становятся рыхлыми межпозвоночные диски. Встречаются формы частичной акромегалии, характеризующиеся ростом отдельных частей тела видимо, происходит локальное повышение чувствительности тканей к соматотропному гормону. Иногда акромегалия сказывается только на периферических эндокринных железах. В этих случаях развивается сахарный диабет тяжелой формы. Он отличается инсулинорезистентностью и компенсируется большими дозами инсулина. У 40 % больных акромегалией наблюдаются узловые формы зоба без признаков гормональной активности щитовидной железы. Течение акромегалии может продолжаться годами. В некоторых случаях происходит спонтанное прекращение роста опухоли, гормональная активность снижается, и тогда акромегалия не прогрессирует. Но наступательное течение акромегалии приводит к потере зрения и к другим тяжелым осложнениям вплоть до летального исхода. Диагноз акромегалии поставить нетрудно, если изменения во внешнем облике резко выражены, сопряжены с наличием головной боли и нарушением половой функции. Акромегалию отличают от других похожих на нее болезней, характеризующихся патологическим ростом костей. При болезни Педжета нет изменений в мягких тканях, трубчатые кости утолщаются и деформируются в проксимальных отделах, мозговая часть черепа увеличивается. На рентгенограммах видны лишь ограниченные участки просветления костной ткани. Арахнодактилия – врожденная патология скелета с усиленным ростом пальцев, становящихся длинными и тонкими, как у паука. У больного арахнодактилией наблюдаются также кифосколиоз, порок сердца, головные боли. Болезнь обусловлена наличием гормонально неактивной хромофобной аденомы гипофиза. При дифференциальной диагностике акромегалию следует отличать от пахидермопериостоза. Последнее заболевание встречается у молодых мужчин. Проявляется утолщением и резким уплотнением региональных участков кожного покрова. Отмечается утолщение пальцев, увеличение в объеме конечностей. Кости черепа и турецкое седло на рентгеновских снимках без изменений, но кожа лица изуродована грубыми жесткими складками и почти не поддается сдавливанию, покрыта бородавками. Наблюдается гипертрофия сальных и потовых желез. Лечение акромегалии направлено на уменьшение продукции соматотропного гормона, а значит, на нормализацию функции межуточно-гипофизарной системы. Радикальный метод лечения акромегалии – это хирургическое удаление опухоли гипофиза. Можно проводить лучевую терапию с целью угнетающего действия на гипоталамо-гипофизарный комплекс. Поначалу лучевая терапия обостряет выделение продукции соматотропного гормона и наступает ухудшение течения сахарного диабета. Но после эффективной лучевой терапии уменьшаются головные боли, восстанавливается менструальный цикл и половая функция, уменьшается содержание соматотропного гормона, фосфора, щелочной фосфатазы в крови. Предложен метод применение радиоактивных изотопов золота и иттрия, которые имплантируются в опухоль транссфеноидальным путем. Половая функция восстанавливается путем дополнительного введения в организм гормонов: эстрогенов и прогестерона – женщинам, тестостерона – мужчинам. Синдром персистирующей лактации Это патологический синдром, проявляющийся непрекращающейся лактацией, атрофией полового аппарата у женщин после родов. Механизм развития этого заболевания основан на повышении продукции пролактина вследствие поражения центров гипоталамуса, которые могли бы оказать тормозящее влияние на образование этого гормона. Происхождение этой болезни во многих случаях обусловлено растущими доброкачественными опухолями гипофиза или гипоталамической области. У больных отмечаются головные боли, недомогание, снижение зрения. Синдром диагностируется наличием выделения молока из молочных желез, не связанным с физиологическим состоянием женщины – беременностью и кормлением ребенка. Хотя в природе и наблюдаются случаи продолжительного периода кормления (ребенка несколько лет), однако кормилица при этом чувствует себя нормально. Лечение персистирующей лактации проводится с помощью гормональной терапией. Прогрессирующий опухолевой процесс подлежит хирургическому лечению. Болезнь Иценко – Кушинга Это сложное, многосимптомное заболевание, характеризующееся нарушением функции гипоталамо-гипофизарно-надпочечниковой системы. Болезнь была исследована и описана в 1924 г. Н. И. Иценко, который считал, что в основе описываемого симптомокомплекса находятся нарушения в системе «межуточный мозг – гипофиз». Кушинг на основании клинических наблюдений и патологических исследований указал на связь этого синдрома с наличием базофильной аденомы гипофиза. Основная симптоматика заболевания связывается с гиперпродукцией глюкокортикоидов. Избыточная стимуляция адренокортикотропным гормоном обусловливает повышение функции коры надпочечников и развитие вторичного гиперкортицизма. Болезнь Иценко – Кушинга развивается в основном у женщин в возрасте 20–40 лет. Больных беспокоят слабость, недомогание, повышенная утомляемость, головная боль, боль в спине, ногах, изменение внешнего облика. Внешний вид больного характеризуется круглым, лунообразным, багрово-красным, порой цианотического оттенка лицом; диспластическим ожирением («буйволовым типом») – отложением подкожного жира в области лица и шеи («жирового горба») в верхней половине туловища и живота при непропорционально худых конечностях; сухой атрофичной кожей с синюшно-мраморным рисунком (отчетливым венозным рисунком на груди и животе); багрово-красными полосами растяжения на коже живота, плеч, молочных желез, внутренней поверхности бедер (полосы в 2–3 см). Полосы эти могут становиться белесоватыми. Их окраска связана с просвечиванием сосудистого ложа через атрофически истонченную кожу. Кожа лица, груди, спины испещрена угрями, фурункулами, мелкими кровоизлияниями, экхимозами. У женщин волосы растут на лице и туловище, но при этом они лысеют. Наблюдается остеопороз позвоночника и ребер. В основе этого процесса – первоначальное поражение белковой матрицы со вторичной деминерализацией костной ткани. Подобные изменения обусловлены катаболическим действием глюкокортикоидов. Костный возраст отстает от паспортного на 6 лет. Особенно это заметно у подростков. Нарушена функция сердечно-сосудистой системы. Наличествует стойкая гипертония. Имеются выраженные изменения в свертывающей системе крови. Кровотечения и тромбоэмболия являются причиной смерти 50 % больных синдромом Иценко – Кушинга. У больных с указанным заболеванием отмечается склонность к возникновению очаговых пневмоний. Изменяются функции почек: наблюдаются альбуминурия, гематурия, цилиндрурия; отмечается снижение концентрационной способности почек. В связи с деминерализацией костей и образованием фосфатных и оксалатных камней развивается почечнокаменная болезнь. Нарушается функция половых желез: менструальный цикл сбивается, у мужчин снижаются либидо и потенция. Развиваются нарушения нервно-психической сферы: больные раздражительны, забывчивы, инфантильны, депрессивны. Наблюдаются ипохондрические расстройства, бессонница. Случаются эпилептиформные припадки, психозы. В анализах крови обнаруживаются эозинопения, лимфопения, лейкоцитоз, эритроцитоз с повышенным содержанием гемоглобина. У больных ослабевает иммунитет; понижается сопротивляемость к различным инфекциям, отчего возникают инфекционные заболевания кожи и мочевых путей, отмечается повышенная склонность к нагноительным процессам. Лечение заключается либо в хирургическом вмешательстве, либо в рентгенотерапии. При незапущенной болезни эффективна рентгенотерапия. При тяжелых, прогрессирующих формах болезни показано оперативное вмешательство – двусторонняя тотальная адреналэктомия с последующей заместительной терапией кортикостероидами. У значительного числа больных после операции нормализуются обменные процессы, исчезают изменения внешнего облика, снижается уровень артериального давления, восстанавливаются половые функции. Одно время клиницистов привлекли препараты, обладающие способностью блокировать синтез кортикостероидов. Позднее появились предложения зарубежных и отечественных ученых применять дексаметазон (0,5–1 мг 4 раза в день с общей дозой на курс 40 мг) и резерпин (0,1 мг 2–3 раза в день с общей дозой на курс до 10 мг). Если при этом нет должного эффекта, следует решать вопрос об оперативном лечении. Нейроэндокринное (гипоталамическое) ожирение Избыточное отложение жира в жировой ткани – это ожирение. Оно развивается вследствие трех основных патогенетических факторов, таких как: 1) повышенное поступление пищи (углеводов, жира) при несоответствующем этому поступлению энергетическом расходовании жира (алиментарное ожирение); 2) избыточное образование жира из углеводов; 3) недостаточное использование (мобилизация) жира как источника энергии (метаболическое ожирение). Пищевой центр регулирует поступление пищи, в том числе и жира и углеводов. Он представляет собой функциональное объединение нервных центров, расположенных в коре головного мозга и нижележащих отделах подкорки и стволовой части головного мозга. Одна из форм проявления деятельности этого центра – чувство аппетита и голода. Большую роль в этом процессе играют нервные образования в заднем гипоталамусе – вентролатеральные и вентромедиальные ядра. Электролитическое разрушение первых вызывает отсутствие аппетита, анорексию – отказ от пищи вплоть до смерти от голодания. Из вентромедиальных ядер («центры сытости») поступают тормозные импульсы к вентролатеральным. Электролитическое разрушение вентромедиальных ядер в связи с выпадением тормозных импульсов вызывает пролонгированное пищевое возбуждение и резко выраженную гиперфагию с последующим развитием ожирения. При введении аутироглюкозы экспериментальным животным наблюдается развитие ожирения. При этом в вентромедиальных ядрах возникают отечность, пикноз ядра, дегенеративные изменения. Аутироглюкозное ожирение является гипоталамическим, но вызывается не электролитическим поражением соответствующих центров, а химическим. Экспериментальное гипоталамическое и аутироглюкозное ожирение является аналогом диэнцефального ожирения. При всех типах ожирения наблюдаются недостаточная энергетическая утилизация жира и торможение мобилизации жира из его депо. Последнее связано, по-видимому, с увеличением содержания гликогена в печени. Сдвиги в функциях эндокринных желез, сопровождающихся тенденцией к гипогликемии, могут быть причиной усиления аппетита и тем самым способствовать ожирению. В этом отношении определенное значение имеет повышение функции инсулярного аппарата. Определенную роль в этом плане могут играть и гипофункция гипофиза, и гипотиреоз, при которых наблюдается гипогликемия. В жировой ткани постоянно идут процессы синтеза и расщепления триглицеридов, гидрогенизация жирных кислот, синтез и распад белка, обмен глюкозы по гликолитическому и фосфоглюконатному пути, образование высших жирных кислот из продуктов обмена углеводов и белка. Отложение жира в жировой ткани происходит не столько при избытке жира, сколько за счет новообразования жира из углеводов. Общий продукт обмена моносахаридов и гликогенных аминокислот – пировиноградная кислота – декарбоксилируется с последующим образованием ацетилкоэнзима А. Последний при участии АТФ конденсируется через ряд этапов в высшие жирные кислоты. Различная степень образования и отложения жира в разных местах жировой ткани связана с неодинаковой выраженностью в них обмена глюкозы. Глюкоза является источником альфа-глицерофосфата, доставляющего глицерин для образования триглицеридов (нейтрального жира). Сама жировая ткань без глюкозы не обладает способностью фосфорилировать свободный глицерин и использовать его для синтеза триглицеридов. Таким образом, активация обмена глюкозы приводит к образованию жира из углеводов. Из гормональных факторов, влияющих на этот процесс, наибольший эффект оказывает инсулин. Он активизирует поглощение жировой тканью глюкозы и стимулирует ее обмен по гликолитическому циклу. В процессе стимуляции гликолитического цикла усиливается образование альфа-фосфата, что способствует увеличению синтеза триглицеридов (нейтрального жира) из новообразованных высших жирных кислот. Инсулин вызывает в изолированной жировой ткани процессы захвата жира клетками жировой ткани. Стимуляция перехода углеводов в жиры происходит и под влиянием пролактина. Наблюдающееся ожирение у женщин в период лактации обусловлено избыточной продукцией пролактина. Если гиперфункция этого гормона сохраняется и после прекращения лактации, то это может стабилизировать ожирение. Таким образом, в этиологии ожирения, обусловленного усилением перехода углеводов в жиры, существенную роль играет избыточная секреция инсулина и пролактина, а также нарушение обмена эстрогенов и, возможно, глюкокортикоидов и тестостерона. Большое влияние на процессы мобилизации жира оказывают гормоны гипофиза. Избыточная секреция тироксина и трийодтиронина активизирует мобилизацию жира в результате возбуждения симпатической нервной системы, которое, в свою очередь, связано с тем, что тироксин, блокируя аминоксидазы, потенцирует действие адреналина и норадреналина. При недостаточной секреции ТТГ, а также вторичной и первичной недостаточности щитовидной железы мобилизация жира из его депо заторможена и создаются предпосылки к ожирению. Ряд гормонов гипофиза полипептидного характера обладают жиромобилизующим действием. Допускается, что оно обусловлено фрагментом полипептидной молекулы, общим для всех органов. Видимо, фрагмент и есть жировой гормон. На основании данных многих исследовательских работ ученые-эндокринологи полагают, что в этиологии ожирения имеет значение изменение функций передней доли гипофиза, ведущее к нарушению биосинтеза того фрагмента компенсаторной молекулы гормонов гипофиза, который имеет отношение к активации и мобилизации жира. Влияние глюкокортикоидов на процессы мобилизации жира сложное. Повышая содержание гликогена в печени и несколько поднимая уровень сахара крови (благодаря активации глюконеогенеза), они способны оказывать тормозящее влияние на мобилизацию жира. Такой же эффект может иметь место из-за угнетающего воздействия глюкокортикоидов на секрецию СТГ и его биологическую активность, а также в результате подавления секреции АТГ с его вненадпочечниковым активизирующим липолиз действием. С другой стороны, глюкокортикоиды оказывают пермиссивное и потенцирующее влияние на жиромобилизующую активность адреналина и нор адреналина. Избыточная секреция глюкокортикоидов не всегда однотипно влияет на отложение жира. Андрогены и эстрогены активизируют мобилизацию жира. По мнению И. Г. Ковалевой и других эндокринологов, эстрогены (синестрол) тормозят жиромобилизующий эффект СТГ. Торможение оказывает и инсулин. Увеличение содержания гликогена в печени замедляет выход жира из жировой ткани. Глюкагон усиливает липолитическую активность жировой ткани. Как бы там ни было, эндокринные железы участвуют в реализации патогенетических факторов, ведущих к развитию ожирения. Участие центральной нервной системы – коры головного мозга, подкорковых образований, симпатической и парасимпатической иннервации – в регуляции жирового обмена, отложения жира в жировых депо, в сложных ферментативных процессах в жировых клетках не подлежит сомнению. Ожирение предрасполагает к развитию целого ряда заболеваний сердечно-сосудистой системы, различного вида нарушениям обмена веществ, гормональным дисфункциям (атеросклерозу, сахарному диабету, холецистогепатиту, желчнокаменной болезни, нарушениям менструального цикла, снижению либидо и потенции), ухудшает состояние опорного аппарата, уменьшает сопротивляемость различным инфекциям. В последние десятилетия стало заметно увеличение числа больных с ожирением, в соответствии с чем возросло и количество сопутствующих заболеваний и осложнений. Классифицируют разные формы ожирения. Алиментарно-конституциональное ожирение обусловлено перееданием (иногда с первых лет жизни), когда потребление пищи превышает энергетические затраты организма. Гипоталамическое (диэнцефальное, межуточно-гипофизарное, нейроэндокринное) ожирение вызывается поражением гипоталамических центров обмена веществ с вовлечением в патологический процесс различных звеньев нейрогормональной системы регуляции. Диффузно-церебральное (многоуровневое) ожирение связано с грубым органическим церебральным процессом (опухолью, энцефалитом), поражающим гипоталамические ядра и другие структуры мозга (кору, подкорковые и стволовые образования), периферическую нервную систему. Эндокринно-метаболическое ожирение обусловлено поражением инкреторных желез (инсулома, кортикостерома, посткастрационный синдром). Клиника гипоталамического ожирения. Ожирение является основным симптомом болезни. Заболеванию подвержены в основном лица молодого возраста. Нарушениям жирового обмена обычно предшествуют инфекции, интоксикации, травмы (вирусные энцефалиты, общесоматические инфекции, ангины, хронический тонзиллит). На ранних этапах заболевания беспокоят головные боли, утомляемость, бессонница, жажда. Прогрессирует прибавка в весе независимо от увеличения или уменьшения рациона. Жир откладывается на груди, животе, бедрах. Появляются сине-багровые или розовые растяжки на коже. Тучность начинает сочетаться с несахарным или сахарным диабетом, могут возникнуть отеки. В неврологическом статусе – рассеянность. В случаях нейровирусной этиологии наблюдаются вегетативно-сосудистые расстройства с нарушениями деятельности сердца, дыхания, озноб с дрожанием всего тела. Формы гипоталамического ожирения делятся по: 1) типу болезни Иценко – Кушинга; 2) типу адинозо-генитальной дистрофии; 3) типу болезни Барракер – Симонса; 4) по смешанному типу. Ожирение по типу болезни Иценко – Кушинга проявляется избыточным отложением жира в области лица, туловища, живота, шеи при относительно худых конечностях. Кожа при этом заболевании сухая, шероховатая, с наличием полос растяжения. Отмечаются нарушение вегетативно-сосудистой регуляции, мраморность кожи, быстрая смена окраски кожных покровов, артериальная гипертония. Гипоталамический тип ожирения наблюдается у лиц с 12 лет и до 35. В основе обменно-гормональных сдвигов лежит повышение продукции гонадотропных, соматотроп ных и адренокортикотропных гормонов в период половой перестройки организма с последующим влиянием их на увеличение белковой и жировой массы тела. Повышается функция коры надпочечников. В частности, усилена секреция глюкокортикоидов. Предшествующими факторами служат ангины, ревматизм, общесоматические инфекции: корь, паротит, скарлатина. Избыток веса у больных с раннего возраста не тревожит родителей до периода полового созревания, в то время как прибавка в весе прогрессирует, а самочувствие ухудшается. Ожирение по типу адинозо-генитальной дистрофии чаще встречается у мальчиков. Отмечается универсальная тучность и отставание в формировании полового аппарата. В основе адинозо-генитальной дистрофии лежит органический процесс, локализующийся в области гипофиза или других участков головного мозга с наличием тяжелого органического поражения. У взрослых эта форма гипоталамического ожирения связана с патологией родового периода (кровотечением, сепсисом). Иногда заболеванию взрослых предшествует травма черепа. Диспластическое ожирение по типу болезни Барракер – Симонса чаще встречается у девочек-подростков и молодых женщин с ревматическим поражением мозга. Характерно чрезмерное отложение жира в нижних отделах туловища – в области бедер, живота. Верхняя часть туловища нормальная и без полос растяжений на коже. Смешанный тип ожирения проявляется равномерным распределением подкожного жирового слоя с преимуществом в области таза, живота и груди. Отчетливо видны полосы растяжения. Отмечается склонность к задержке воды в тканях с уменьшением диуреза (до 400–600 мл в сутки). Нарушение водного баланса вызывает отеки. Появляются признаки повышенной функциональной активности инсулярного аппарата. Содержание гликогена в крови больных ожирением повышено. При патологической тучности активизируется переход пищевых углеводов в гликоген, чем ослабляются импульсы к мобилизации жира. Глюкокортикоидная функция коры надпочечников повышена. Нарушена функция половых желез. Половое созревание замедлено. У подростков с гипоталамическим ожирением отмечаются признаки диспропорции телосложения. Снижена мышечная сила. Плохо развиты вторичные половые признаки – растительность на лице. Изменяется щитовидный хрящ гортани. Сохраняется высокий тембр голоса. Размеры полового члена малы, мошонка недоразвита, яички маленькие. У девочек отмечается нарушение менструального цикла, но хорошо развита мышечная система плечевого пояса и большое количество акне (угрей) на коже лица, груди, явления гирсутизма. С прогрессированием ожирения страдают функции внутренних органов: повышается артериальное давление. Особенно страдает печень. Даже на ранних этапах болезни удается установить нарушение углеводной, белковой, протромбино-образовательной, антитоксической и других функций печени. В дальнейшем развивается ангиохолит, холецистогепатит. Со стороны желудочно-кишечного тракта наблюдается склонность к запорам, метеоризму, повышение кислотности желудочного сока. Функция мочевыделительной системы заметно не страдает. Лечение ожирения связано с серьезными трудностями и должно носить комплексный характер. При любом типе клинического течения заболевания и степени ожирения необходимо во время лечения соблюдать режим питания. Акцент делается на снижение возбудимости пищевого центра. С этой целью переходят на дробное питание (5–6 раз в сутки). В рацион вводятся продукты, богатые клетчаткой (капуста, морковь, свекла). Предпочтительны свежие овощи и зелень, содержащие тартроновую кислоту, которая препятствует переходу углеводов в жиры. Для мобилизации жира из жирового депо уменьшают калорийность пищи за счет углеводов, количества жиров, но увеличивают количество белков животного происхождения. Целесообразно употребление творога, сыра, содержащих липотропные факторы. Ограничивается поваренная соль, исключаются пряности, приправы, экстрактивные вещества, алкогольные напитки. Суточное количество калорий: 1200–1800 (20 калорий на 1 кг расчетного веса). Назначаются разгрузочные дни: кефирные, рыбные, овощные, фруктовые. Устанавливается режим усиленной физической активности (лечебная физкультура, ходьба, бег). Полезны водные процедуры (душ, плавание, обтирание). При прогрессирующих формах ожирения в лечение вводят дозированное голодание с соблюдением правильной методики выхода из голода и дозированной физической нагрузки. Лечение голодом проводится в условиях стационара. Назначают препараты липотропного действия, пантотенат кальция, сосудорасширяющие и другие средства. Анаболические стероиды и глютаминовая кислота используются с целью улучшения процессов белкового обмена и предотвращения распада тканевых белков. Наряду с диетотерапией назначают комплекс дегидратационной, десенсибилизирующей и рассасывающей терапии (внутримышечные введения сульфата магния, глюконата кальция, мочегонные, антигистаминные препараты). При выраженных явлениях ликворной гипертензии показана дегидратационная терапия. Применяются снижающие содержание холестерина средства (липокаин, метионин, липоевая кислота, клофибрат, линетол, петамифен), витамины группы В. Гормональная циклическая терапия (эстрогены, прогестерон, хориогонин) назначаются в случаях полового инфантилизма или обратного развития полового аппарата, и установленной гормональной недостаточности. Мальчиков с нерезко выраженным гипогонадизмом лечат хориогонином (с 10–12 лет). При явно выраженном гипогенитализме, крипторхизме применение хориогонина начинают с 6–8 лет. Синтетические аналоги или мужские половые гормоны назначают с 12-летнего возраста. Взрослым при снижении либидо и потенции тоже назначают половые гормоны, параллельно – общетонизирующие и общеукрепляющие препараты. В случаях снижения функциональной активности щитовидной железы назначают тиреоидинотерапию. Исключается применение анорексигенных препаратов, так как они способствуют кратковременной потере веса, влекут за собой побочные явления, а именно стойкие нарушения сосудистой регуляции, нарушения менструального цикла. Опасен длительный прием мочегонных и слабительных средств. Это способствует ухудшению метаболических процессов (нарушается электролитный обмен, развивается колит, почечная недостаточность вследствие спазма сосудов, вызванного гипокалиемией, возможны головная боль, коллаптоидное состояние). Следует иметь в виду гипергликемизирующее действие тиазидовых соединений. Лучевая терапия рекомендуется в случаях заболевания по типу болезни Иценко – Кушинга с прогрессирующими обменно-гормональными нарушениями. Решающее значение имеет режим питания. Постоянно проводимые психотерапевтические мероприятия – разъяснение вреда переедания и обязательного соблюдения диеты – является важным условием лечения нейроэндокринных форм ожирения. Прогрессирующая липодистрофия (болезнь Барракер – Симонса) Заболевание, которому предшествуют различные формы энцефалитов, общесоматические инфекции и травмы черепа; в отдельных случаях – опухоль мозга. Порой этиологию заболевания объяснить невозможно. Болезнь связана с поражением межуточного мозга. Это достаточно редкая форма патологии. Заболевание характеризуется атрофией подкожной жировой клетчатки в области лица, шеи, плечевого пояса, грудной клетки при нормальном или избыточном отложении жира в нижней половине тела. Заболевание развивается обычно с детства. Так, в 204 случаях наблюдений отмечено развитие прогрессирующей липодистрофии в возрасте до 10 лет у 40,8 % женщин и у 88 % мужчин. Патологический процесс сочетается с обменными и гормональными нарушениями – несахарным диабетом, приступами гипогликемических состояний, отечным синдромом, сахарным диабетом. В некоторых случаях отмечаются признаки органического церебрального процесса: головные боли гипертензионного типа, вестибулярные расстройства, снижение остроты зрения. В лечении используется комплекс общеукрепляющих средств, витамины группы В, липотропные вещества, массаж, водные процедуры. При нарушении функции эндокринных желез (сбой менструального цикла, сахарный, несахарный диабет) назначается гормональная терапия. Болезнь Деркума характеризуется локализованными болезненными жировыми отложениями, сочетающимися с нервно-психическими и эндокринными изменениями (расстройством функции половых желез). В основе заболевания возможны опухоль, травма, воспалительный процесс головного мозга. Часто причину заболевания установить не удается. На фоне универсальной тучности формируются жировые узлы, болезненные при пальпации. Обширные и болезненные жировые узлы удаляются хирургическим путем. Адипозо-генитальная дистрофия – это заболевание, сочетающее ожирение и гипогенитализм. В понятия этой болезни включаются только такие формы, при которых ожирение и недоразвитие половых признаков появляются в детском возрасте и природу заболевания установить не удается (предполагается плохая наследственность, связанная с хромосомными аберрациями). При ясной причине болезни (опухоль, травма мозга, энцефалит) ожирение и гипогонадизм следует считать симптомами патологического процесса. Заболеванию чаще подвержены мальчики. Оно характеризуется ожирением, гипогенитализмом, нарушением процессов роста, дебильностью. Характерным является отложение жира в области груди, живота, таза, бедер, лица. Кожа чистая, оволосение в постпубертатном периоде у мальчиков по женскому типу. Развитие первичных и вторичных половых признаков заторможено. У мальчиков это проявляется очень малыми размерами мошонки, полового члена. У девочек гипоплазию генитального аппарата можно обнаружить при гинекологическом обследовании. У детей нередко выявляются врожденные формы патологии полового развития. Со временем отмечаются расстройства деятельности сердечно-сосудистой и дыхательной систем, печени, желудочно-кишечного тракта. Среди нарушений в эндокринной системе чаще всего имеет место несахарный диабет. В лечении рекомендуется активная терапия двух основных синдромов – ожирения и гипогенитализма. Лечение задержки полового развития детей и подростков излагается в последующих разделах по лечению задержки полового развития. Синдром гипермускулярной липодистрофии – это заболевание, которое характеризуется чрезмерным развитием скелетной мускулатуры, полным исчезновением подкожной жировой клетчатки на туловище и других участках тела, атрофией молочных желез, гипертрофией клитора и малых губ. Синдром гипермускулярной липодистрофии развивался после перенесенных больными инфекций или травм головы. Высказывается предположение о гипоталамо-гипофизарном генезе синдрома гипермускулярной липодистрофии и связи его развития с активизацией мезодиэнцефальных структур и повышением секреции гормона роста. Заболевание начинается с головных болей, болей в мышцах, быстрой утомляемости, нарушения менструального цикла, усиления полового влечения, появления жажды, частого и обильного мочеиспускания. У многих больных повышается артериальное давление, имеют место серьезные и явные формы сахарного диабета, расстройства менструального цикла, бесплодие. При лабораторном исследовании определяется непостоянное увеличение уровня экскреции 17 КС с повышением фракции андростерона, повышенное содержание прегнандиола в моче. Уровень гормона роста в крови повышается на 20–35 %. Синдром Морганьи – Морель – Стюарта Это патология, характеризующаяся гипоталамо-гипофизарными расстройствами, проявляющимся ожирением, патологическим оволосением и утолщением внутренней пластинки лобной кости. Заболевание в 1762 г. описано Дж. Морганьи. Ранней жалобой больных является сильная постоянная головная боль в области лба и затылка. Со временем развивается прогрессирующее ожирение, дряблость кожи и подкожной жировой клетчатки. На лице жирным становится подбородок; живот отвисает в виде большого фартука; молочные железы большие; ноги утолщены из-за отеков. Полосы растяжек на коже отсутствуют. Растут борода и усы. В кожных складках располагаются мокнущая экзема, гнойничковые поражения. Часто отмечается тромбофлебит кожных вен в области отвисшего живота, на ногах – варикозные расширения вен, трофические язвы. Сердце расширено влево, артериальное давление повышено, акроцианоз губ. Имеются расстройства менструального цикла, но возможно наступление беременности, приводящей к прогрессированию ожирения. На рентгенограмме черепа наблюдаются шероховатые утолщения на внутренней поверхности лобной (теменной) кости, локальные обызвествления твердой мозговой оболочки. Лечение синдрома Морганьи – Морель – Стюарта состоит в соблюдении режима, исключающего дальнейшее прогрессирование ожирения и нарушения углеводного обмена. Несахарный диабет Несахарный диабет – это заболевание, которое характеризуется полидипсией, полиурией с низким удельным весом мочи. Только в прошлом веке появились обстоятельные работы по несахарному диабету, была установлена связь этого синдрома с патологией центральной нервной системы и задней доли гипофиза. В основе заболевания лежит поражение системы «супраоптическое ядро – супраоптико-гипофизарный тракт – нейрогипофиз». Патологический процесс на любом из этих уровней приводит к уменьшению продукции антидиуретического гормона (АДГ). Заболеванию могут предшествовать травмы черепа, острые и хронические психические травмы, многочисленные инфекции (малярия, скарлатина, тифы, бруцеллез и др.). Развитие несахарного диабета часто происходит после перенесенного гриппа. Болезнь может быть наследственной (семейной формой заболевания). В идиопатических случаях заболевание обусловлено органическим поражением мозга. В развитии заболевания имеет значение снижение функциональной способности канальцевого эпителия почек реагировать на АДГ или усиленная инактивация гормона печенью и почками. В таких случаях может наступить относительная недостаточность АДГ в отличие от абсолютной, связанной с нарушением продукции антидиуретического гормона. В вариантах врожденного несахарного диабета обнаружено уродство почек (кистозная почка, расширение лоханок почек, уретры, дегенеративные изменения дистальной части извитых канальцев). У больных этого плана отмечается снижение чувствительности канальцевого эпителия почек к действию антидиуретического гормона, обнаруживается нарушение процессов реабсорбции воды и электролитов, что и находится в основе резистентности к адиуректину. Несахарный диабет может возникнуть внезапно или развивается постепенно. Появляются постоянная жажда и частые позывы на мочеиспускание. Они не проходят и ночью. Прозрачная и бесцветная моча выделяется по 500–800 мл. В ней отсутствуют белок и сахар. В моче отмечается минимальный осадок, у детей наблюдаются ночное недержание мочи, задержка роста и полового развития. Больные вследствие потери аппетита теряют вес вплоть до истощения. И дети, и взрослые делаются раздражительными, капризными. У женщин «сбивается» менструальный цикл, беременности прерываются выкидышами, однако нормальная детородная функция может сохраниться. Если больному ограничить поступление жидкости в организм, то ему станет совсем плохо: появится резкая сухость во рту, головная боль, слабость, тошнота, повышение температуры тела и психические нарушения. После перенесенной инфекции или черепно-мозговой травмы вскоре могут возникнуть симптомы несахарного диабета. Проходящие явления несахарного мочеизнурения могут отмечаться во время беременности и при нейровирусных заболеваниях. Диагноз несахарного диабета ставится при наличии полиурии, полидипсии и низкого удельного веса мочи. Дифференцируют прежде всего несахарное мочеизнурение с сахарным диабетом. Диагноз сахарного диабета ставится при наличии повышенного уровня сахара в крови, глюкозурии, высокого удельного веса мочи. Но в жизни случаются сочетания этих двух заболеваний. Очень трудно дифференцировать диагноз несахарного диабета и психогенной полидипсии. Они протекают с аналогичной клиникой болезни. Наличие жажды и полиурии у больных с психогенной полидипсии бывает только в дневное время. Они хорошо переносят воздержание от приема жидкости. Лечение несахарного диабета направлено на уничтожение причины заболевания, на устранение жажды и полиурии. Опухоль межуточно-гипофизарной области не поддается лучевой терапии, ее удаляют хирургическим путем. Заболевание несахарным диабетом вследствие сифилиса можно вылечить при помощи противосифилитической терапии. Отмечен случай, когда сахарный диабет, возникший в связи с заболеванием малярией, был устранен хинином. Несахарный диабет, развившийся после гриппа, поддается комплексной терапии (антибиотиками, десенсибилизирующими средствами). Нейроинфекционный процесс лечится антибиотиками, биохинолом. Эффективным методом лечения несахарного диабета является заместительная терапия препаратамизадней доли гипофиза. Адиуректин – препарат из порошкообразно измельченной высушенной задней доли гипофиза крупного рогатого скота. Вводится эндоназально («понюшками») по 0,03 – 0,05 г 2–3 раза в день. Через полчаса после приема «понюшки» проходит жажда и реже появляются позывы к мочеиспусканию. Правда, антидиуретический эффект лишь обеспечивает ночной сон (6–8 ч.). Экстракт задней доли гипофиза – питуитрин – вводится больному подкожно по 0,5–1 мл 5 – 10 ЕД 2–3 раза в день и оказывает этим антидиуретическое действие на 10 ч. Пролонгированный препарат антидиуретического гормона в виде жировой суспензии траннатовой соли вазопрессина – питресситаннант – вводят внутримышечно в дозе 1 – 10 МЕ для облегчения состояния на 5 суток. На течение несахарного диабета благоприятно влияет бутадион, увеличивающий реабсорбцию воды и натрия в почечных канальцах, не изменяя клубковую фильтрацию. Бутадион в дозе 0,4–0,6 г в сутки снижает диурез с 6–9 л до 1–2 л, нормализует сон и на полгода возвращает больным в трудоспособность. Отмечается снижение диуреза на 60 % после приема 100 мг дихлотиазида (мочегонное средство). Но эта парадоксальная реакция чревата развитием гипокалиемии, поэтому наряду с дихлотиазидом необходимо принимать препараты калия. Несахарный диабет чаще всего остается хроническим заболеванием на всю жизнь, и больным постоянно приходится заниматься лечением. Однако заместительная терапия позволяет им сохранять трудоспособность. Гипергидропексический синдром (синдром Пархона) Болезнь описана врачом Пархоном в 1933 г. Она характеризуется олигурией, задержкой жидкости в организме, отсутствием жажды. Этиология болезни связывается с гиперпродукцией антидиуретического гормона гипофиза. Нарушение функции гипоталамуса и его регуляции водного обмена (повышение продукции альдостерона) часто зависит от токсико-инфекционных и аллергических факторов. Больные прибавляют в весе, жалуются на головные боли, слабость, нежелание пить, уменьшение диуреза. Возникают отеки конечностей. В неврологическом статусе появляется рассеянность. Наблюдаются снижение либидо, импотенция. Кровь «забивается» холестерином, нейтральными жирами, хлоридом натрия. В моче повышено содержание антидиуретического гормона и альдостерона. Гипергидропексический синдром – заболевание редкое. Но разные формы нарушения водного обмена («идиопатические отеки») связаны с нарушением функции гипоталамуса, секреции альдостерона, дисфункцией половых желез. Примечательно, что появление отеков наблюдается за несколько дней до менструации. Для лечения в больших дозах применяют мочегонные средства. Препараты окситоцин, фенамин, кортикостероиды антагонистичны в отношении продукции АДГ. Их используют для лечения синдрома Пархона. В рационе ограничивают поваренную соль. Пища обогащается овощами и фруктами. Назначается лечебная физкультура. Заболевания щитовидной железы Гормоны щитовидной железы, их биосинтез, метаболизм и биологическое действие Щитовидная железа отвечает за нормальный процесс обмена веществ. Нарушения ее гормонообразовательных функций влечет за собой деструкцию, разбалансирование нервной системы, патологии развития головного мозга. Беременная женщина с больной щитовидной железой может родить психически неполноценного ребенка. От щитовидной железы зависит, как будет реагировать гипоталамус на состав крови. В щитовидной железе тиреоидные клетки поглощают и концентрируют йод, доставляемый к ней током крови. От недостатка йода происходит ослабление выработки гормонов тироксина и трийодтиронина. Помимо названных йодированных гормонов щитовидная железа производит тиреокальцитонин – гормон, который участвует в поддержании уровня кальция в крови. Йодированные тиреоидные гормоны Йод поступает в кишечник с растительной и белковой пищей и даже с вдыхаемым воздухом, всасывается в кровь в виде отщепленного йодида и переносится к щитовидной железе. На первом этапе интратиреоидного гормоногенеза йодид в тиреоидных клетках окисляется в атомарный йод. Молекула тирозина, поглотив атомарный йод, становится монойодотирозином (МИТ). Затем йод оказывается в кольце пятого положения тирозина, и МИТ становится дийодтирозином (ДИТ). Тиреоидные гормоны – это результат объединения йодтирозинов в йодтиронины. Две молекулы дийодтирозина, соединившись, преобразуются в тироксин (тетрайодтиронин – Т4). Молекула дийодтирозина, слившись с молекулой монойодтирозина, становится гормоном трийодтирониом (Т3). Аминокислоты йодтиронины и йодтирозины являются частичками гликопротеида – тиреоглобулина. Именно он заполняет фолликулы щитовидной железы. Транспортные формы тиреоидных гормонов циркулируют в крови. Йодтиронин распадается и инактивируется в печени. Отщепившийся с желчью йод попадает в кишечник. Всасываясь из крови, он вновь используется щитовидной железой для создания тиреоидных гормонов. От состояния печени и кишечника зависят нормальное функционирование пути попадания йода в организм. Влияние йодированных тиреоидных гормонов на организм очень многообразно вследствие того, что они воздействуют на все виды обменных процессов. На белковый обмен тиреоидные гормоны влияют двояко. С одной стороны, они задерживают азот в организме, усиливая синтез белков, с другой – будучи в избыточном количестве, они форсируют распад скелетно-мышечных белков (особенно сердечной мышцы), тем самым увеличивая выделение мочевины. Избыток тиреоидных гормонов стимулирует углеводный обмен. Печень, сердце, скелетные мышцы при этом теряют гликоген, поскольку форсируется гликогенолиз. Усиливается всасывание глюкозы в кишечнике и повышается ее метаболизм в тканях. Жировой обмен активизируется под влиянием гормонов щитовидной железы. При недостаточности тиреоидных гормонов провоцируется развитие атеросклероза из-за повышения уровня холестерина в крови. Но в большом количестве они угнетают образование жиров из углеводов. Риск атеросклероза в условиях гипертиреоза минимален. На водно-минеральный обмен тиреоидные гормоны влияют, усиливая диссимилярные процессы, чем увеличивается выведение электролитов с мочой. Но в организме задерживаются натрий, хлор и калий, если тиреоидных гормонов в нем мало. Интенсивность обмена веществ понижается при недостатке тиреоидных гормонов. Происходит задержка воды в тканях. При нарушениях функции щитовидной железы страдает и витаминный обмен. Недостаточность тиреоидных гормонов проявляется желтизной кожи, так как в печени из каротина витамин А образуется слабо. При гипертиреозах усиливается утилизация углеводов и ослабляется формирование тиамина. В связи с этим организму недостает витаминов комплекса В (В12), и развивается гиповитаминоз витамина С и пантотеновой кислоты. Влияние тиреоидных гормонов на нервную систему.Достаточный уровень тиреоидных гормонов необходим для нормальной деятельности центральной нервной системы. В противном случае развиваются необратимые дегенеративные изменения в нейронах коры головного мозга. Слабоумие, кретинизм обусловливаются угнетением высших отделов центральной нервной системы гипотиреозом. Возникновению психической неустойчивости способствует и избыток тиреоидных гормонов, так как они то возбуждают, то тормозят нервную систему. Действие тиреоидных гормонов на мышцы и сердечно-сосудистую систему.От избытка тиреоидных гормонов прогрессируют слабость и миопатии мышц за счет уменьшения синтеза креатинофосфата. И избыточное, и недостаточное функционирование щитовидной железы влияет на минутный объем крови. Тахикардия – симптом гипертиреоза. Влияние тиреоидных гормонов на кровь и кроветворение. При сверхнорме тиреоидных гормонов в костном мозге усиливается эритропоэз, а в крови отмечается ретикулоцитоз. Содержание лимфоцитов в крови возрастает. Развивается гиперплазия вилочковой железы, лимфатических узлов. Уменьшение тиреоидных гормонов ослабляет регенерацию крови, что приводит к анемии. Желудочно-кишечный тракт.Нарушение нормы выработки тиреоидных гормонов сказывается на отделении желудочного сока и перистальтике. Повышение или понижение их уровня действуют соответственно. Деятельность печени напрямую зависит от тиреоидных гормонов. Жировая дегенерация, очаги некроза, отек и цирроз обнаруживаются в увеличенной при тиреотоксикозе печени. Тиреоидные гормоны усиливают в ней распад жира и белков, гликогена, окисления глюкозы. При длительной тиреоидной недостаточности происходит обильное отложение мукоидных веществ в соединительной части кожи. Появляются слизистые отеки. Заместительная терапия препаратами тиреоидина Т4 или Т3 приводит к исчезновению мукоидных отложений в коже. Избыток тиреоидных гормонов вызывает гипертрофию мозгового вещества надпочечников, увеличивают секрецию глюкокортикоидов. Усиливается их распад в печени. Кортизол превращается в кортизон. Как следствие – быстро разрушается альдостерон. Процессы деградации кортикостероидов замедляются при недостаточности тиреоидных гормонов. Истощение коры надпочечников является результатом длительного избыточного действия тиреоидных гормонов. При недостаточности тиреоидных гормонов гонады претерпевают дегенеративные изменения. От избытка этих же гормонов уменьшается способность к оплодотворению. Функциональная повышенная активность щитовидной железы и избыток секреции тиреоидных гормонов наблюдаются в периоде лактации. Концентрация жира в молоке возрастает. Участие щитовидной железы в обмене кальция.При заболеваниях костей остеолитического характера участие йодированных тиреоидных гормонов в продукции тиреокальцитонина не вполне выяснено. Регуляция щитовидной железы Щитовидная железа – это огромная капсула, внутри которой находится множество перегородок, соединительно-тканных прослоек. В этих прослойках располагается очень много нервных волокон и кровеносных сосудов. Если появляется какая-то патология, то происходит увеличение самой железы. Тиреоидный гормон передней доли гипофиза (ТТГ) стимулирует щитовидную железу. В случае неблагополучия с гипофизом нарушается и вся функциональная деятельность щитовидной железы. Изменение состояния гипоталамуса тоже вызывает реакцию щитовидной железы. Регуляция щитовидной железы обусловлена не только влиянием тиреоидного гормона, но и другими факторами, в том числе воздействием гормонов надпочечников, половых желез. Адреналин действует возбуждающе на щитовидную железы, глюкокортикоиды угнетают функциональную деятельность щитовидной железы. Зависимость активности щитовидной железы от женской половой сферы заметна в период полового созревания. Происходят сдвиги в функциональной активности, в ее размерах и структуре, в поглощении ею йода. Увеличивается связывание белками Т4 и Т3 кровяной плазмы. Велико действие йода на щитовидную железу. Лечебное применение малых доз йода или йодистых препаратов при тиреотоксикозе и для профилактики эндемической зобной болезни основывается на ослаблении деятельности щитовидной железы, что уменьшает пролиферацию тиреоидной паренхимы. Но избыток йода также вреден для щитовидной железы. Отщепление тироксина от тиреоглобулина не происходит вовремя, нарушается циркуляция тиреоидных гормонов, а внутри фолликулов щитовидной железы возникают коллоиды. Порой, как уже было сказано, происходит разрушение фолликулов, нерасщепленный тиреоглобулин выходит из фолликулов (допустим, фолликулярная стенка разорвалась от переполненности), а тиреоглобулин является антигеном, вызывающим процесс аутоиммунизации. Этот процесс создает патогенез аутоиммунного тиреоидита. Его субстратом становится интенсивная инфильтрация щитовидной железы лимфоцитами. Возникают лимфоидные фолликулы, которые начинают размножаться. Появляется и развивается лимфоидный зоб. Типы зобной трансформации щитовидной железыКлассификации заболеваний щитовидной железы до сих пор остаются достаточно неопределенными. Наиболее распространенной является следующая. I. Врожденные аномалии щитовидной железы (аплазия, гипоплазия, эктопии, незаращение языково-щитовидного протока, дающее начало кистам или свищам). II. Эндемический зоб с разделением: 1) по степени увеличения щитовидной железы – 0, I, II, III, IV, V; 2) по форме: диффузный, узловой, смешанный; 3) по функциональным проявлениям: эутиреоидный, гипер– и гипотиреоидный, гипотиреоидный с признаками кретинизма. III. Спорадический зоб с разделениями по степени. IV. Токсическая аденома. V. Диффузный токсический зоб (синонимы: базедова болезнь, тиреотоксикоз, первичный тиреотоксический диффузный зоб) с разделением на формы тяжести: 1) легкая; 2) средняя; 3) тяжелая. VI. Гипотиреоз с разделением по тяжести: 1) легкий; 2) средний; 3) тяжелый. VII. Воспалительные заболевания щитовидной железы: 1) тиреоидит (струмит) острый (гнойный, негнойный); 2) тиреоидит подострый; 3) тиреоидит хронический; 4) туберкулез щитовидной железы; 5) сифилис щитовидной железы; 6) паразитарные заболевания (например, эхинококк щитовидной железы); 7) актиномикоз щитовидной железы. VIII. Травматические повреждения: 1) открытые; 2) закрытые. IX. Злокачественный опухоли: 1) рак; 2) саркома; 3) метастазирующая аденома; 4) гемангиоэндотелиома. Вся эта классификация весьма условна. Зобная трансформация щитовидной железы Зобом считают увеличение щитовидной железы. Она деформирует контуры шеи. На начальной стадии заболевания зоб поддается лечению. «Юношеский зоб» – маленькое увеличение размеров щитовидной железы появляется во время полового созревания. Но вскоре щитовидная железа без лечения возвращается к своим изначальным формам. Если же этого не происходит, значит, началось прогрессирующее заболевание и функциональное увеличение превращается в зоб. Все начинается с гиперплазии тиреоидного эпителия. Эпителиальные зобы могут быть либо диффузными, либо узловатыми. Узлы бывают кистозные, напряженно эластичные. Крупные узлы вызывают атрофические изменения. В смешанных зобах есть диффузная гиперплазия и узлы. Зобная трансформация щитовидной железы имеет разные структурные формы: паренхиматозный зоб, коллоидный, безйодофицированный, базедовский. Диффузный токсический зоб (тиреотоксикоз) – распространенное эндокринное заболевание при избытке йодированных тиреоидных гормонов. Всегда очень трудно выделить какую-то конкретную причину болезни. Существует мнение, что острые и хронические психические травмы, многократные инфекции нервно-психического перенапряжения часто являются причиной болезни. Заболевания щитовидной железы могут носить наследственный характер. Процесс заболевания начинается с увеличения поглощения йода щитовидной железой, повышенного выброса продукции йодированных тиреоидных гормонов и интенсивного их поступления в циркуляцию крови. Конечно, здесь имеет место дискоординация деятельности гипоталамуса. Иногда тяжелый тиреотоксикоз не вызывает внешнего увеличения шеи. Но уже говорилось о том, что строение зоба многовариантно. Одновременно происходит структурное изменение других внутренних органов. Возможны патологические изменения в сердце, почках, печени. Обнаруживаются отек мягкой мозговой оболочки, деструкция нервных клеток, гиперплазия вилочковой железы, селезенки, лимфатических узлов, атрофические изменения в надпочечниках, яичниках, инсулярном аппарате поджелудочной железы, дистрофия базофильных клеток в передней доли гипофиза. Внешне все это может выражаться в пучеглазии, раздражительности, похудении, в слабости и утомляемости, в дрожании рук. Самые яркие проявления тиреотоксикоза отражаются на нервно-психической сфере и проявляются суетливостью, нетерпеливостью, конфликтностью, психической неустойчивостью. Больные становятся слезливыми по каждому поводу, их мучают либо бессонница, либо тревожный сон, чередование гнева с депрессией. Происходит ухудшение памяти, но может наблюдаться чрезмерная непродуктивная активность, торопливая сбивчивая речь. Возможно дрожание конечностей, век, губ, головы и туловища. Тяжесть тиреотоксикоза является причиной глазных расстройств. Это проявляется злокачественным экзофтальмом – особой формой патологии – нарастающим пучеглазием. Больные ощущают боли, чувство жжения и песка, давление глазных яблок, светобоязнь, двоение предметов. Экзофтальм может и не являться признаком тиреотоксикоза. Повышенная утомляемость мышц проявляется в «подкашивании ног», бессилии встать без помощи рук из положения «на корточках», приступообразной слабостью бедренных мышц. Радикальные изменения вследствие влияния тиреотоксикоза отмечаются и в сердечно-сосудистой системе. Изменяются функции внешнего дыхания и газообмена: появляются признаки дыхательной и кардио-респираторной недостаточности. Изменяются секреторная и моторно-эвакуаторная функция желудка: мало выделяется желудочного сока, но усиливается перистальтика, и понос становится для больного обычным явлением. Лечение тиреотоксикоза обычно проводится в стационаре, где создаются необходимые условия психического и физического покоя. Большое значение для успешного лечения больного имеет обеспечение его 9 – 12-часовым глубоким сном. Для этого назначают бром, успокоительные средства. В рациональное диетическое питание вводят легкоусвояемые продукты, комплекс витаминов и минералов. Синтетические препараты дийодтирозин, перхлорат калия, мерказолил, йод – основные средства лечения тиреотоксикоза. Йод не назначается при токсической аденоме. Тиреостатические препараты совместно с резерпином хорошо помогают в лечении легких форм заболеваний щитовидной железы. При средней тяжести тиреотоксикоза назначают 30–40 мг в день мерказолила, 1–1,5 г перхлората калия, реже – 0,2–0,3 г дийодтирозина. Больным с признаками сердечно-сосудистой недостаточности назначают препараты успокаивающего действия, бета-блокаторы с сердечными глюкозидами. При сопутствующем тиреотоксикоз поражении печени больным рекомендуют применение метионина, липокаина, витамины В6 и В12, холина хлорид. В борьбе с истощением используется глюкозо-инсулиновая терапия, анаболитические стероиды. Преднизолоном устраняют явления гипокортицизма. Упорядочивают менструальный цикл эстрогенами и прогестероном. Через полгода, в случае неэффективности терапии, прибегают к оперативному лечению. Тяжелая форма тиреотоксикоза лечится тиреостатическими препаратами, только если нет сопутствующих изменений во внутренних органах. Как правило, сопутствующие сердечно-сосудистые заболевания лечат новокаиномидом, резерпином, хлоридом калия, мочегонными препаратами. Общетонизирующие мероприятия (душ, обтирание), грязелечение сопутствующих заболеваний также показаны при тиреотоксикозе. Вторичные формы тиреотоксикоза как следствие органических поражений мозга (травма, энцефалит) подлежат комплексному лечению. Тиреостатические препараты совмещают с дегидратационной, противовоспалительной, рассасывающей терапией (бийохинол, дипразин, димедрол, комплекс витаминов В, антибиотики, внутримышечное введение 25 %-ного сульфата магния, внутривенные вливания 10 %-ного раствора хлорида кальция). Экзофтальм лечится тиреостатическими препаратами (тиреоидином по 0,03 – 0,05 г 2 раза в день или трийодтиронином по 10–30 мг в день). Злокачественный экзофтальм вылечить чрезвычайно сложно, поскольку заболевание зависит от патологического процесса, приведшего к функциональному нарушению активности щитовидной железы. Инфекционное поражение мозга лечится комплексно: рентгенооблучением диэнцефальной области с одновременным применением антибиотиков, уротропина, хлористого кальция, димедрола, сульфата магния. Конъюнктивы, отек периорбитальных тканей облучают рентгеном 600 – 1000 Р на курс. Развивающееся злокачественное пучеглазие у больных тиреотоксикозом лечат путем облучения большими дозами рентгена (диэнцефально-гипофизарной области) сначала через день по 50 – 200 Р с трех полей: переднее, теменное, два боковых. В сумме доза составляет 2000–3000 Р. Через полгода проводят второй курс лечения с интервалами облучения в 6–7 дней. Злокачественное пучеглазие лечат кортикостероидами; назначают преднизолон по схеме: 5 мг 3 раза в день в течение недели, 5 мг 2 раза в день в следующую неделю, 5 мг один раз в день в третью неделю, 5 мг через день в течение полутора недель и 2,5 мг через день 12 дней. Хирургическое вмешательство в прогрессирующий экзофтальм может значительно повысить риск еще более усугубляющейся деструкции (протрузии) глазных яблок. Своевременное лечение является важным условием его успешности. Тиреостатический криз снимается резерпином, седативными средствами, внутривенным введением гидрокортизона (400–600 мг в сутки) капельным внутривенным вливанием жидкостей, 0,5 %-ного новокаина, раствора Люголя с йодидом натрия, разведенным в 1 л 5 %-ной глюкозы. Возможно использование в терапии тиреотоксиче-ского криза бета-адреноблокаторов. Чрезмерное количество тиреоидных гормонов приводит в действие катехоламины. Происходит острая адренергическая вспышка. Такой больной нередко умирает. И причиной смерти является развитие фибрилляции желудочков, сенсибилизированных выбросом тиреоидных гормонов. Это они стимулируют циркулирующий в крови катехоламин. Адренергическая активность резко увеличивает уровень неэстерифицированных жирных кислот в крови. Такое наблюдается после введения адреналина или у лиц, страдающих феохромоцитомой. Бета-адреноблокаторы нормализуют уровень неэстерифицированных жирных кислот. Но интенсивное лечение, направленное на спасение такого больного, должно продолжаться 7 – 10 дней, так как именно столько действует выделенный в кровь гормон, который необходимо блокировать. Лечение радиоактивным йодом: тиреоидная паренхима в диффузном токсическом зобе интенсивно собирает йод из крови. Излучение, выделяющееся при распаде введенного радиоактивного йода, деструктирует фолликулы, склерозируя железистую ткань и, таким образом, редуцирует зоб. Эффект лечения радиоактивным йодом почти аналогичен хирургическому методу. Радиойодтерапией тиреотоксикоза занимаются специалисты. Они владеют методами такого способа лечения, при этом учитывают показания и противопоказания. Показания к радиойодтерапии. 1. Если больному более 40 лет и при наличии у него диффузного зоба II и III степени у щитовидной железы осталась способность йодопоглотителя, но ему так и не помогла медикаментозная терапия. 2. Тяжелая недостаточность кровообращения как осложненная форма тиреотоксикоза. 3. Наличие множества сопутствующих поражений: недостаточность кровообращения после инфаркта, хроническое гнойное воспаление, острые психозы, гипертонические кризы. 4. Рецидивы тиреотоксикоза при послеоперационных осложнениях. Противопоказания к радиойодтерапии. 1. Тиреотоксикоз у детей, подростков, беременных женщин, кормящих матерей, смешанные формы зоба, токсическая аденома, загрудинный кольцевой зоб, сдавливающий трахею. 2. У больных тиреотоксикозом до 40 лет, наблюдаются лейкопения, тяжелые степени диффузного зоба. Хирургическое лечениеПоказания. 1. В первой (невротической) стадии оперативное лечение недопустимо. 2. Во второй (нейрогормональной) стадии, если на протяжении 8 месяцев консервативная терапия не произвела должного эффекта, больному просто необходима хирургическая операция. 3. В третьей (висцеропатической) стадии заболевания при наличии и функциональных, и морфологических изменений во внутренних органах в ситуации, когда ни медикаментозное лечение, ни радиоактивный йод не помогли. 4. Глубокие изменения во всем организме. Противопоказания к хирургическому лечению: 1. Послеинфарктное состояние, спазмы кровеносных сосудов. 2. Тяжелые необратимые изменения печени, почек, сердечно-сосудистой и дыхательной систем. 3. Психические заболевания. На современном этапе развития хирургии и эндокринологии практически не существует противопоказаний к оперативному лечению при тиреотоксикозе. После адекватной подготовки большинство больных может быть оперировано. Нервно-психическим больным накануне операции следует назначить валериану, мепропотан, резерпин, снотворное. Больным с сердечно-сосудистой декомпенсацией необходимо использовать новокаинамид. За три недели до операции следует подлечить печень, для чего нужно употреблять камполон, липокаин, метионин. Правильная предоперационная подготовка больных находится в компетенции специалистов и включает в себя индивидуальный подход, учет стадии заболевания, предусмотренные требования данной методики, послеоперационную рациональную диету, серьезное внимание к угрозе развития тиреотоксиче-ского криза в послеоперационном периоде. Токсическая аденома Заболеванию подвержены обычно женщины. У них образуется узел (аденома), отличающийся от диффузного токсического зоба патогенезом. Аденома возникает не в результате усиления действия тиреотропного гормона, а как следствие расстройства нервной импульсации, получаемой участками тиреоидной паренхимы. Увеличение щитовидной железы замечается, когда аденома достигает размеров зоба. Этому предшествуют жалобы больного на слабость, повышенную раздражительность, снижение веса, сердцебиение, снижение работоспособности, головные боли, плаксивость, повышенную влажность кожи, дрожание пальцев вытянутых рук. Лечение токсической аденомы, как опухоли щитовидной железы, может быть только оперативным с тщательной предоперационной подготовкой. Гипотиреоз Гипотиреоз – состояние, обусловленное недостаточностью функции щитовидной железы. Его происхождение зависит от: 1) недоразвития щитовидной железы (причина кретинизма) или врожденная аплазия; 2) частичного или абсолютного выключения щитовидной железы (рентгеновское облучение); 3) ослабления гормонообразовательной деятельности щитовидной железы (реакция на тиреостатические агенты); 4) ослабления гормонообразовательной деятельности щитовидной железы (воспалительный процесс, дегенерация тиреоидной паренхимы); 5) генетической предрасположенности к нарушению биосинтеза тиреоидных гормонов. Так называемый вторичный гипотиреоз является результатом удаления гипофиза или его поражения, что делает невозможным продукцию тиреотропного гормона. Опухоли и поражения гипоталамуса создают тот же самый гипотиреоз. Больные гипотиреозом слабеют, чувствуют головные боли, отекают, теряют аппетит, затрудняются с опорожнением кишечника, раздражительны, малоработоспособны, сонливы. Больного гипотиреозом можно узнать по «тестообразному» лицу, отечности век, тусклому взгляду, утолщенным губам. Кожа у него шелушащаяся, с отеком подкожно-жировой клетчатки на шее, на тыльной поверхности рук и подошв. Голос становится низким и глухим, нарушается артикуляция речи. Волосы истончаются и выпадают, ломкими делаются ногти. Человек толстеет за счет задержки жидкости в организме. Изменения в нервно-психической сфере проявляются заторможенностью, вялостью психических реакций, равнодушием к жизни, снижением интеллекта, ухудшением памяти. Из-за снижения интенсивности обменных процессов при гипотиреозе страдает сердечно-сосудистая система. Снижается скорость кровотока, пульс становится реже и слабого наполнения. Рентгенограмма констатирует увеличение размеров сердца. Функции желудка и кишечника замедляются по причине развивающейся ахлоргидрии. Утолщенный язык не помещается во рту. Разрушаются и выпадают зубы. Отмечается плохой запах изо рта, метеоризм, запоры. Кишечник не реагирует даже на слабительные. У женщин нарушается менструальный цикл и рано наступает климакс. Редко вынашивается беременность, прерываясь либо преждевременными родами, либо самопроизвольным абортом. У мужчин исчезает либидо, нарушается сперматогенез. В связи с уменьшением секреторной и реабсорбционной способности почечных канальцев снижается диурез. Могут наблюдаться инфекции мочевыводящих путей. Нарушаются все виды обмена веществ. Повышается уровень холестерина крови. При врожденном гипотиреозе с трехмесячного возраста отмечается вялость и сонливость, отсутствие у ребенка реакций на свет и шум. С течением времени кретинизм становится явным. Развитие организма отстает от паспортного возраста. Зобная эндемия (эндемический кретинизм) – отчетливое увеличение размеров щитовидной железы протекает на фоне различных степеней слабоумия вплоть до идиотии. Приобретенный гипотиреоз Заболевание может развиться у детей вследствие неполноценного питания (белкового) либо голодания, перенесенной инфекции. Проявление тиреоидной недостаточности выражается задержкой роста, физического и полового развития, замедленностью психических реакций, сонливостью, склонностью к запорам, неприятным запахом изо рта, снижением интеллектуальных способностей. У взрослых могут быть неотчетливые проявления гипотиреоза: либо головокружение, либо плохой аппетит, чувство вздутия живота. Нарушения функций периферической нервной системы могут быть признаками начала гипотиреоза. Это радикулиты, невриты. Нарушение походки из-за расстройства глубокой чувствительности. Черепно-мозговые нервы обязательно вовлекаются в патологический процесс. Нередко развиваются генерализованные судорожные приступы, перемежающаяся хромота и снижение температуры тела до 31 С. Гипотиреоидная кома Если не лечить гипотиреоз, то может наступить тяжелое осложнение. В случае переохлаждения, физической травмы, инфекции ухудшается состояние, падает артериальное давление. Человек со снижением температуры до 23–24 °C рискует впасть в гипотермальную кому. В 90 % случаев такая кома заканчивается летально. Диагноз гипотиреоза установить сложно. Врожденная идиотия, болезнь Дауна внешне похожи на гипотиреоз. Только лабораторные тесты и тщательное обследование позволяют правильно установить диагноз. Лечение направлено на компенсацию дефицита тиреоидных гормонов и нормализацию обменных процессов. Порошок высушенной щитовидной железы – тиреоидин – небольшими дозами (0,05 г 2–3 раза в день) рекомендуется лицам пожилого возраста. Дозу постепенно увеличивают до 0,15 – 0,2 г в день. Тироксин медленно проникает в клетки, устойчиво связывается с белком и аккумулируется. Максимальный эффект наступает к концу второй недели лечения, но уже слегка дает о себе знать через три дня. В дальнейшем оставляют поддерживающую дозу (0,3–0,5 мг в день). При лечении используют методику двухдневного перерыва после 5 дней применения тиреоидина и тироксина. Препарат второго гормона щитовидной железы – трийодтиронин – проникает в клетки более быстро, но оказывает не очень продолжительный эффект. При гипотиреоидной коме вводят внутривенно трийодтиронин по 100 мкг каждые 12 ч. или каждые 4 ч. по 25 мкг с одновременным приемом гидрокортизона по 50 – 100 мг каждые 6 – 12 ч. Больные должны строго придерживаться рациона с ограничением жиров и продуктов с большим количеством холестерина. Во многих случаях назначают сердечные средства и диуретики. Для нормализации функции печени назначают липокаин, метионин, витамины В6 и В12. Для устранения анемии применяют препараты железа. Восстанавливают менструальный цикл циклической гормональной терапией. Лечение вторичного гипотиреоза требует специального плана, разработанного специалистами-эндокринологами. Зобная болезнь Сущность эндемической зобной болезни заключается в ее географическом распространении в биогеографических областях с пониженным содержанием йода в среде (в воде, почве, растительных пищевых продуктах, в воздухе). Возникновение эндемической зобной болезни вследствие дефицита йода доказывается профилактикой данного недуга препаратами йода. Гиперплазия паренхимы щитовидной железы – это реакция организма на недостаточность поступления в него йодированных тиреоидных гормонов. Причиной этого может быть не только дефицит йода в окружающей среде, но и нарушение процессов биосинтеза в самой железе. Определяются внешние и внутренние причины нарушения интратиреоидного гормоногенеза. Внешние причины: недостаточное поступление йода в организм, обусловленное действием тиреостатических веществ, образующихся в процессах деятельности человека. Так, в некоторых сортах капусты, репы, крестоцветных растений, брюкве, турнепсе тиоцинаты в виде гликозидов обладают тиреостатическими свойствами. В растениях они никак себя не проявляют. Но в кишечнике животных активизируются и переходят в молоко коров. Попав к человеку в молочных продуктах, «агенты» порой становятся причиной зобной болезни. Вещества эти называют «струмигенами». Дефицит йода в среде в сочетании с наличием струмигенов в пищевых продуктах могут стать факторами, обусловливающими зобную эндемию. Йод не всегда оказывается в форме, доступной для всасывания в организм. Часто дефицит йода в среде сочетается и избытком в ней солей кальция. Некоторые опыты показали, что кальций провоцирует пролиферацию тиреоидной паренхимы. Риск заболевания зобной болезнью для населения, проживающего в географических очагах с дефицитом йода и с избытком кальция, значительно повышается. На возникновение и распространение зобной эндемии влияют санитарно-гигиенические условия. По мере улучшения их в среде обитания число больных, страдающих зобной болезнью, уменьшается. Предположения об инфекционном характере массовости зобного заболевания напрашиваются сами собой. Но микробного возбудителя ученым выявить не удалось. Значит, отрицательные гигиенические факторы просто усиливают эффект йодной недостаточности. Спорадическая зобная болезнь Гиперплазия тиреоидной паренхимы наслаивается ростом эпителиального слоя, что впоследствии становится зобом. Болезнь наблюдается и в районах, где с содержанием йода в среде благополучно, а причиной болезни является понижение способности щитовидной железы поглощать йод и йодировать тирозин, т. е. нарушение интратиреоидного метаболизма йода, а значит, недостаточное образование тиреоидных гормонов. Возможно, это расстройство связано с генетически обусловленным отсутствием некоторых ферментов в тиреоидных клетках. Дефекты гормоногенеза многообразны: 1) врожденная пониженная способность железистых клеток щитовидной железы поглощать и накапливать йод; 2) недостаточность или инактивация ферментных систем, осуществляющих окисление йода в атомарный йод; 3) нарушение или ослабление соединения (комплексация) йодтирозинов в йодтиронины. Механизмы, которые активизируют и контролируют пролиферацию тиреоидной паренхимы, учеными окончательно не установлены. Порой эндемическая и спорадическая зобная болезни развиваются исподволь и постепенно, а под влиянием нервного перенапряжения, например перемены места жительства, травмы, аборта, родов, ускоряется проявление болезни. Только в начальной стадии эндемической зобной болезни при ее лечении целесообразно применение йодистых таблеток, содержащих по 1 мг калия йодида (по 1 таблетке 2–3 раза в неделю). При спорадической форме зоба лечение направляется на увеличение способности щитовидной железы использовать поступающий извне йод. Следует учесть возможность злокачественного перерождения узловатых зобов, и при отсутствии эффекта лечения их тиреоидными препаратами необходимо своевременно решать вопрос о хирургическом вмешательстве. Обычно это делается после 2–3 месяцев лечения тиреоидными препаратами. Аутоиммунный тиреоид (болезнь хасимото) Аутоиммунным тиреоидом чаще страдают женщины. В крови больных (в сыворотке) находят тиреоидные аутоантитела с высокими титрами. Аутоантитела, образующиеся в результате реакции на наличие в организме аутоантигенов, действуют цитотоксически на паренхиму щитовидной железы. Паренхима прогрессирующе разрушается. Начальными проявлениями заболевания являются слабость, головные боли. По мере прогрессирования заболевания снижается работоспособность, так как ослабляется память и «уходят» силы. Могут умеренно увеличиться лимфатические узлы. В процессе аутоагрессии появляются признаки более выраженного гипотиреоза. Это вялость, заторможенность, отеки, облысение, появление тучности. Зоб, увеличиваясь в размерах, начинает давить на трахею, чем затрудняет дыхание; появляется удушье, нарушается тон голоса. Диагноз аутоиммунного тиреоида ставится с привлечением лабораторных методов. Уменьшение зоба после применения глюкокортикоидов является косвенным подтверждением диагноза аутоиммунного тиреоида. Лечение должно проводиться с привлечением средств, снижающих антигенный стимул, оказывающих влияние на процесс аутоиммунизации, чтобы его притормозить и тем самым устранить лимфоцитоз и плазмоцитоз. Гормональный препарат тиреоидин способен уменьшить явления гипотиреоза, т. е. уменьшить зоб и снизить уровень аутоантител. На лечение могут уйти несколько месяцев или лет. Главное – правильно установить дозу тиреоидина. В лечении используются и трийодтиронин, глюкокортикоиды и АКТГ, кортизон и преднизолон. Но рассчитывать на успех бесполезно, если разрушение паренхимы щитовидной железы дошло до необратимой стадии. К другим заболеваниям щитовидной железы относятся неспецифические воспалительные (острые тиреоидиты), туберкулез, сифилис, актиномикоз, фиброзный тиреоидит, рак. «Почва» для появления этих заболеваний – острая или хроническая инфекция (грипп, ангина, скарлатина, тифы, эпидемические вирусные болезни, хронический тонзиллит, ревматизм, туберкулез, сифилис). Причиной воспаления могут быть интоксикации окисью углерода, свинцом, йодом, а также травмы. Воспалительные процессы переходят в гнойные, если их вовремя не приостановить. Возбудители гнойных тиреоидитов – стрептококки, стафилококки и пневмококки. Благодатной почвой для гнойного процесса является узловатая форма зоба. Лечат воспалительные процессы антибиотиками (пенициллином, стрептомицином, тетрациклином), кортикостероидами, амидопирином, анальгином, натрия салицилатом. Своевременное хирургическое лечение узлового зоба является профилактикой рака щитовидной железы. Щитовидная железа склонна к гиперплазии. Такого многообразия пролиферативных процессов, как в щитовидной железе, не встречается ни в одном другом органе. Имеется общность патогенезов гиперплазии щитовидной железы, аденомы и рака. Первая причина гиперплазии – дефицит йода, вторая – блокировка биосинтеза тиреоидных гормонов – тиреостатина. У подопытных крыс хронический дефицит йода создавал мутационные изменения тиреоидных клеток и аномалию структуры хромосом. Уровень тиреотропного гормона при тиреоидном раке повышается незначительно. Но влияние на происхождение рака щитовидной железы оказывают нарушения взаимоотношений между гормонообразованием в ней и секрецией ТТГ. Первые признаки злокачественных процессов, происходящих в зобе, – прогрессирующий рост опухоли за очень маленький отрезок времени, ограничение подвижности зоба, его плотность. Очаг злокачественного новообразования в щитовидной железе поначалу едва заметен по причине малого размера и определяется лишь при гистологическом исследовании на неоднократных срезах. Бывают случаи смешанного заболевания щитовидной железы. В зобе может рак сочетаться с болезнью Хасимото. Но диагностика рака щитовидной железы связана с трудностями, и отличить это заболевание от других видов заболеваний щитовидной железы может только гистологическое исследование удаленного во время операции узла. Лечение рака щитовидной железы всегда является комплексным. Применяется лучевая терапия, прием трийодтиронина и тиреоидина. Хирургическое вмешательство остается основным методом лечения. Даже в запущенной стадии заболевания с отдельными метастазами показана радикальная операция. Хирургически удалив злокачественный очаг, отдаленные метастазы можно лечить радиоактивным йодом. Вообще виды рака, с которыми борются радиоактивным йодом, развиваются менее злокачественно. Радиоактивный йод подавляет функции неизмененной щитовидной железы. Тиреотропный гормон увеличивает поглощение йода опухолевой тканью. Для усиления тиреотроп-ной функции гипофиза на длительное время назначают тиреостатические препараты. Долговременный прием тиреоидина в дозах до 1 г в сутки дает хорошие результаты. Наступает объективная ремиссия. При неоперабельных формах рака щитовидной железы, рецидивах и метастазах, в послеоперационном периоде для предупреждения рецидивов опухоли и метастазов назначают тиреоидин и трийодтиронин. Во многих случаях тиреоидные гормоны целесообразно принимать пожизненно. Заболевания околощитовидных желез Две пары небольших желез тесно прилегают к задней поверхности щитовидной железы. Они образовывают тиреопаратиреоидный комплекс с общим кровоснабжением и иннервацией, совместно участвуют в регуляции кальциевого обмена, чем поддерживают уровень кальция в крови. Как известно, в структуре скелета кальцию отведена существенная роль. Участвует он и в механизме транспорта многих веществ через мембраны, в механизме секреции гормонов и в действиях ферментных систем, во многих других жизненно важных процессах. Околощитовидные железы вырабатывают паратиреоидный гормон, который влияет на концентрацию кальция в крови. Тиреокальцитонин, продуцируемый щитовидной железой, понижает кальциемию. Паратиреоидный гормон и тиреокальцитонин должны находиться в динамическом равновесии. Если происходят нарушения во взаимодействии между этими гормонами, то изменяется не в лучшую сторону состояние скелета. Избыточное действие паратгормона излишне повышает уровень кальция крови, а значит, его теряет костная ткань. Ее защищает фиброзная ткань. Паратгормон действует через активацию остеокластов, ферменты которых усиливают деполимеризацию мукополисахаридов вещества кости. Таким образом, высвобождается кальций. Процессы реабсорбции кости притормаживает тиреокальцитонин. Уровень кальция в крови для нормальной жизнедеятельности организма должен поддерживаться на постоянном уровне. Если, к примеру, удалить околощитовидные железы, то это приведет организм к смерти. Сначала наступит депрессия, возбудимость нервов и мышц до подергиваний, переходящих в судороги, а через некоторое время наступает смерть. Во время тетанического припадка содержание кальция в крови оказывается равным всего 4–7 мг %. Даже одна из четырех околощитовидных желез (если она сохранится) может обеспечить организм (за счет компенсаторной гипертрофии) паратиреоидным гормоном (паратгормоном). Гипопаратиреоз Недостаточность функции околощитовидных желез уменьшает продукцию парагормона (удаление одной из них или ослабление их деятельности). Снижение кальция в крови приводит к судорогам. Но возможно возникновение судорожного синдрома, не связанного с патологией околощитовидных желез. Нарушение поступления кальция в организм или увеличение его выделения из организма может быть обусловлено недостаточным всасыванием кальция в кишечнике или связано с нарушением деятельности почек и т. д. Функциональная недостаточность околощитовидных желез влечет за собой многочисленные нарушения в кожных покровах (экзема), в костной системе, в желудочно-кишечном тракте. У больного наблюдается резкое истощение организма, страдают сердечно-сосудистая система, почки. Независимо от причин возникновения гипопаратиреоза заболевание характеризуется возбудимостью нервно-мышечного аппарата и склонностью к развитию судорог. При врожденной или приобретенной патологии околощитовидных желез развивается идиопатическая форма тетании. Заболевание является хроническим с чередованием стадий: то скрытой, то обостренной. Операция на щитовидной железе чревата травматическим повреждением околощитовидных желез, в результате чего возможно развитие гипопаратиреоза, т. е. снижение выработки гормона этих желез – паратгормона. В связи с этим может развиться острая форма тетании. Возникает ощущение «ползания мурашек», чувство онемения, скованности в конечностях и в области рта. Вскоре наступают судороги отдельных групп мышц. Мускулатура лица охватывается тоническим спазмом, рот становится подобен рыбьему с сардонической улыбкой. У больных возникают распирающие боли в мышцах лица. Наиболее опасен при тетании ларингоспазм – одышка при наступающем спазме голосовой щели, спазм мускулатуры бронхов и диафрагмы. Если ларингоспазм будет продолжаться длительно, то может наступить смерть. Развитию приступа предшествуют похолодание конечностей и чувство онемения в них. Спазм может начинаться с любых групп мышц – в мускулатуре кишечника, в мышцах радужной оболочки глаз, в мышечном аппарате мочевого пузыря. Скрытые формы тетании: повышенная возбудимость двигательных волокон лицевого нерва. Нарушения психики появляются редко. В единичных случаях наблюдаются неврастенические и истерические припадки. Функциональная недостаточность околощитовидных желез проявляется изменением кальциево-фосфорного обмена. У женщин обострение симптомов тетании связано с менструальным циклом (это связано с влиянием эстрогенов на обмен кальция). У беременных и кормящих тетания (судороги) обусловлена отрицательным балансом кальция, который чрезмерно расходуется в организме будущей матери для развития плода, а также в период лактации. Для лечения гипопаратиреоза применяют экстракт околощитовидных желез крупного скота (паратиреоидин), он помогает устранить расстройства, вызванные гипопаратиреозом. Эффект наступает через 2–3 ч. после инъекции. Спустя 18 ч. повышается содержание кальция в крови. Рекомендуется диета, бедная фосфором, но богатая кальцием, употребление витаминов D1, D2, D3 и дигидротахистерола (АТ-10). Эти препараты стабилизируют содержание кальция в крови. Спленин – вещество, выделенное из селезенки крупного рогатого скота, – также повышает содержание кальция в крови. В лечение следует включать успокаивающие средства (бром, фенобарбитал). Гиперпаратиреоз Частая причина заболевания – гормонально-активная опухоль (аденома) околощитовидных желез, вызывающая чрезмерную выработку паратгормона. Избыточная продукция этого гормона вызывает патологические изменения в костях и почках. Гиперпаратиреоз проявляется общей слабостью, утомляемостью, мышечной гипотонией, болями в костях. Жажда и полиурия (выделение большого количества мочи) становятся постоянными симптомами. Проявлениями заболевания могут быть тошнота, рвота, снижение аппетита. Возможно развитие мочекаменной болезни. Появляются ноющие боли в костях, могут развиться их деформация и патологические переломы. На рентгенограмме можно увидеть участки разреженности кости. В костях черепа обнаруживаются просовидные зернистости с очагами просветления. Гигантоклеточные опухолевидные образования, похожие на костные кисты – признаки гиперпаратиреоза. Костной деструкции сопутствуют изменения функции почек. Это является подтверждением гиперпаратиреоза. Камни в почках обнаруживаются только рентгенологически, и они, как правило, коралловидные. Радикальный метод лечения гиперпаратиреоза – хирургический. Удаление гормонально-активной аденомы околощитовидных желез дает замечательный лечебный эффект: исчезают боли, нормализуется минеральный обмен, начинают хорошо срастаться переломы, приостанавливаются остеодистрофические изменения костного скелета, улучшается функциональное состояние почек. Заболевания надпочечников В 1849 г. медики впервые обратили внимание на значение для организма надпочечников. Заболевание последних получило название болезни Аддисона. Потеря обоих надпочечников для высших животных и для человека смертельна. С одним оставшимся надпочечником можно жить без существенных изменений в организме. Надпочечники – парная эндокринная железа, располагается над верхними полюсами почек, состоит из коркового, подкоркового и мозгового слоя. Надпочечники находятся на уровне от XI грудного до I поясничного позвонка. Размеры надпочечников у различных людей не одинаковы, но их средняя длина составляет 45 мм, толщина – 6 – 10 мм, ширина – 25–30 мм, вес – 10–12 г. Надпочечники хорошо кровоснабжаются. Артерии, проходящие через кору, продолжаются рассыпанными капиллярами между скоплениями медуллярных клеток. Лимфатические капилляры располагаются в прослойках соединительной ткани между столбами коры и между клеточными тяжами в мозговой части. Раздражение чревных нервов усиливает продукцию адреналина в мозговой части, и далее он выделяется в венозную кровь. Повреждение чревных нервов ослабляет функцию мозговой части. Гормоны надпочечников Из экстракта коры надпочечников в 1933 г. удалось выделить кортикостерон. После было получено более 50 стероидных соединений. Гормоны коры надпочечников в зависимости от числа атомов углерода в них делятся на три группы соединений: соединения с 21 атомом углерода (С21-стероиды), с 19 атомами (С19-стероиды) и с 18 атомами (С18-стероиды). Последние две группы – половые гормоны (андрогены и эстрогены), а С21-стероиды – собственно кортикостероиды, обладающие специальным для гормонов коры надпочечника биологическим эффектом. Из всех соединений наибольшей физиологической активностью обладают только три кортикостероида, которые постоянно определяются в крови, оттекающей от надпочечника: кортизол, кортикостерон и альдостерон. Остальные соединения тоже играют свою роль, являясь предшественниками этих гормонов или же метаболитами – 17-окси-11-дезоксикортикостерон, 11-дезоксикортикостерон (ДОК), 19-оксикортикостерон, 11-дегидрокортикостерон, кортизон. Больше всего секретируется надпочечниками кортизол, потом кортикостерон и только около 200 мкг – альдостерона. Альдостерон – минералокортикоид, участвует в регуляции водно-солевого обмена, а кортизол и кортикостерон – глюкокортикоиды, участвующие в регуляции углеводного, белкового и жирового обмена. У кортизола есть свои органы-«мишени», т. е. те органы, на которые он избирательно оказывает влияние: печень, лимфоидная ткань, мышцы, миокард, почки, соединительная ткань. Он попадает к ним с током крови и метаболизируется. Кортизол постоянно расходуется. За 90 мин. он обновляется. Кортизол участвует в регуляции обмена углеводов, белков и жиров; реакции организма на действие стресс-факторов (травмы, инфекции); водно-электролитного обмена; механизмов стабилизации артериального давления; возможно, воспалительной реакции. При функциональной недостаточности надпочечников организм становится уязвимым. Чрезмерные физиологические нагрузки (холод, непосильный труд), стресс – все это напряжение для организма. Повышаются функции надпочечников. При стрессе гипофиз выделяет адренокортикотропный гормон, стимулирующий секрецию гормонов коры надпочечников. Они включают механизмы адаптации к неблагоприятным воздействиям. Адаптационный механизм имеет этапы: 1) реакция тревоги: шок и противошок (воздействие повреждающего агента и шок-гипотония и т. д.; тяжелое воздействие – гибель; противошок – в результате активации коры надпочечников возникают физиологические сдвиги, способствующие восстановлению нарушенного гомеостаза – артериального давления, мышечного тонуса, водно-солевого баланса); 2) стадия резистентности (повышенные адаптивные возможности организма); 3) стадия истощения в случае продолжительного повреждающего действия, когда адаптивное действие гормонов гипофиза и коры надпочечников может оказаться недостаточным и организм погибает. Альдостерон (стероид-минералокортикоид) является основным естественным гормоном коры надпочечника, регулирующим водно-солевой обмен. В крови он частично связывается с белками. Метаболизм альдостерона происходит в основном в печени. Известны далеко не все пути метаболизма этого гормона. Альдостерон и вазопрессин (АДГ) являются основными гормонами, регулирующими водно-солевой гомеостаз. Между уровнем внеклеточного калия (калиемией) и секрецией альдостерона существует прямая связь. Понижение секреции альдостерона (гипоальдостеронизм) – признак Аддисоновой болезни. Введение заместительных доз альдостерона нормализует артериальное давление и водно-электролитные нарушения. Всем известный адреналин (эпинефрин) является гормоном мозгового вещества надпочечников. Позднее было выяснено, что мозговым слоем продуцируется и норадреналин (артеренол, норэпинефрин). Адреналин и норадреналин имеют предшественника – аминокислоту тирозин. Все они называются катехоламинами. Высшие центры, контролирующие функции мозгового вещества надпочечников, локализованы в коре головного мозга, ретикулярной формации и гипоталамусе. Они посылают по спинномозговым путям нервные импульсы к большому чревному нерву и далее – к клеткам мозгового вещества надпочечников, вызывая выброс катехоламинов в кровь. Они оказывают специфическое действие на тонус периферических кровеносных сосудов и таким образом влияют на кровоснабжение и функцию различных органов. Адреналин вызывает сужение сосудов чревной области и кожи и расширение сосудов поперечно-полосатой (скелетной) мускулатуры и миокарда. В отличие от адреналина норадреналин обладает суживающим действием на все сосудистые образования, повышая периферическое сопротивление кровотоку. В связи с этим различием проявляется адаптивное свойство адреналина как «гормона тревоги». Он может дифференцированно воздействовать на различные сосудистые области и в стрессовых ситуациях перераспределять кровоснабжение в пользу жизненно важных органов. Несомненное приспособительное значение имеет расслабление мускулатуры бронхов под влиянием адреналина, благодаря чему улучшается легочная вентиляция. Катехоламины действуют на гладкую мускулатуру органов, вызывают сокращение сфинктеров, пиломо-торных мышц, расширение зрачка. Действие адреналина на углеводный обмен происходит более активно, чем норадреналина. Но вместе они вызывают мобилизацию жирных кислот, активизируя липазу жировой ткани, в связи с чем повышается уровень свободных жирных кислот в крови, а при длительном действии (например, при феохромоцитоме) отмечается похудение. Адреналин активизирует окисление жирных кислот. Катехоламины создают энергетические ресурсы, активизируя гликогенолиз и липолиз. Облегчается потребление кислорода тканями. Метаболическим действием гормонов объясняется их калорический эффект – усиление теплообразования, что имеет значение для терморегуляции. Хроническая недостаточность коры надпочечников (болезнь Аддисона, гипокортицизм) Первичная недостаточность коры надпочечников является результатом поражения самих надпочечных желез, вторичная – возникает из-за понижения секреции АКТГ в связи с нарушением функции гипоталамо-гипофизарной системы. Болезнь может развиваться в связи с сифилитическим процессом, скарлатиной, тифом, опухолью, метастазами злокачественных новообразований. Часто причина патологии остается неясной. Это могут быть грипп, ангина, ревматизм и т. д. Гипоплазия и атрофия коры надпочечников случаются у пациентов, получавших глюкокортикоиды из-за различных заболеваний (бронхиальной астмы, ревматизма и др.). В пораженных надпочечниках среди клеток возникают очаги некроза, надпочечники сморщиваются ^ и уплотняются, уменьшаются в размерах. Кожные покровы больного получают избыточное количество меланина и приобретают бронзовую окраску. В патологический процесс вовлекаются многие органы – поджелудочная, щитовидная, вилочковая железы. Уменьшается продукция гормонов коры надпочечников. Больные ощущают резкую слабость до полного бессилия, однако они не могут уснуть, психически возбудимы, теряют аппетит, при виде пищи их тошнит, отмечаются позывы к рвоте, боли в животе. Артериальное давление снижается. Заболевание диагностируется с помощью лабораторных исследований. Лечение зависит от степени выраженности болезни. При легкой форме заболевания состояние компенсируют диетой, богатой углеводами и бедной солями. Из рациона исключают горох, фасоль, бобы; мясо, фрукты, картофель ограничивают. Поваренная соль употребляется в количествах не более 10 г в сутки. Больным недостаточностью коры надпочечников средней и тяжелой формы для компенсации нарушенных углеводного, белкового, водного и солевого обменов показана заместительная терапия. Назначают препараты, обладающие минералокортикоидным (ДОКСА, альдостерон, фторгидрокортизон) и глюкокортикоидным (кортизон, гидрокортизон, преднизолон, дексаметазон и др.) действием. Индивидуальная лечебная доза контролируется специалистом. Применение гормонов с минералокортикоидными свойствами возможно лишь при отсутствии у больных выраженных нарушений сердечно-сосудистых расстройств, углеводного обмена, снижении веса. Но при отсутствии перечисленных явлений требуется употребление дополнительных глюкокортикоидов: преднизолона – 10–20 мг, дексаметазона – 1–2 мг, гидрокортизона – 25–50 мг в сутки. При улучшении состояния пациента дозу снижают. Полезно включить в лечение аскорбиновую кислоту – до 1 г в сутки. Лечение аддисонического криза, который может развиться при чрезвычайных состояниях организма (травма, инфекция и т. д.) и проявляющегося резким усугублением имеющейся симптоматики, падением артериального давления, развитием гипогликемии, должно быть энергичным. Срочно принимают меры по борьбе с дегидратацией и шоковым состоянием больного: вводят внутривенно 2–2,5 л 5 %-ной глюкозы и физраствора с добавленными 4–6 мл кордиамина, 50 мг аскорбиновой кислоты и капельно внутривенно 1–2 мл 0,1 %-ного норадреналина, растворенного в 1 л 5 %-ной глюкозы. Одновременно назначаются инъекции 10 %-ного раствора кофеина 2–3 раза в сутки. Наряду с этим вводят по 100 мг гидрокортизона или по 30–40 мг преднизолона внутримышечно каждые 4–6 ч. При улучшении состояния больного количество физраствора сокращают до 1–1,5 л, дозу гидрокортизона – до 50 мг, ДОКСА – до 5 мг в сутки; последний отменяют при нормализации давления. При исчезновении желудочно-кишечных расстройств, рвоты физраствор отменяют. Затем в течение суток л рекомендуется употреблять 5 г лимоннокислого натрия и 50 г глюкозы на 1 л воды. Острая надпочечниковая недостаточность чаще всего развивается в результате массивных кровоизлияний в надпочечники. Заболевание может возникнуть в любом возрасте, но все же оно чаще вызывается травмой при длительных, трудных родах, сопровождающихся асфиксией плода и наложением щипцов, гемолитической болезнью новорожденного, тяжелыми инфекционными болезнями. Болезнь имеет молниеносное течение: начинаются озноб, боли в животе, рвота, понос, одышка, падает давление, затем наступают судороги и коматозное состояние. Большая часть новорожденных с этой патологией умирает в первые дни или часы после рождения. Врожденная вирилизирующая гиперплазия коры надпочечников Заболевание развивается вследствие нарушения синтеза гормонов в коре надпочечников, в связи с чем в организм поступает избыточное количество стероидов с адрогенным действием. У девочек происходит увеличение клитора до размеров полового члена. Мочеиспускательный канал находится у основания клитора. В возрасте 2–5 лет происходит оволосение: рост волос на лобке, в подмышечных впадинах, на лице, спине, конечностях. Наблюдается ускоренный рост: костный возраст превышает паспортный, чрезмерно развивается мускулатура. Девочки приобретают мужеподобный вид. У мальчиков с врожденной гиперплазией коры надпочечников изменения замечаются в возрасте 2–3 лет. Половой член у них достигает таких же размеров, как и у взрослых. Возникает эрекция, грубеет голос, сильно развивается мускулатура, но отсутствует аппетит, понижен общий тонус. У 10 % больных отмечается рвота, гипотония, наступают судороги, коллапс. Внезапно может наступить летальный исход. Следует правильно поставить диагноз врожденной вирилизирующей гиперплазии надпочечников, так как есть другие типы псевдогермафродизма и истинного гермафродизма. Для дифференциации диагноза опухоли надпочечников и врожденной вирилизирующей гиперплазии применяется проба с кортизоном, преднизолоном или дексаметазоном. При введении 100 мг кортизона или 20 мг преднизолона в течение 5 дней при гиперплазии коры надпочечников выделение с мочой 17-КС резко уменьшается из-за подавления секреции АКТГ кортизоном (при наличии опухоли выделение 17-КС не снижается). Врожденную вирилизирующую гиперплазию лечат устранением дефицита кортизона, чем нормализуют выделение гипофизом АКТГ и снижают экскрецию надпочечниками андрогенов. Дозу больным назначают в зависимости от возраста. Детям до года вводят внутримышечно по 10 мг гидрокортизона в сутки, 3 – 4-летним – 25–30 мг, а более старшим – 50 мг в сутки. Спустя 10 дней подавляется андрогенная функция коры надпочечников. Применяются также преднизолон по 5 – 20 мг или дексаметазон по 0,5–1 мг в сутки. Лечение мальчиков поддерживающими дозами кортизона или преднизолона продолжается до окончания их полового созревания, а девочек лечат всю жизнь. Лечение тем эффективнее, чем раньше оно начато. В этом случае дети развиваются без отклонений: у девочек прекращается вирилизация, приходит цикл менструаций, у мальчиков созревают семенники. В истории бывали случаи беременности и родов у бывших больных. Девочкам с выраженными деструкциями наружных половых органов можно сделать пластические операции. Если вирилизм сочетается с синдромом потери соли, то кортизонотерапию дополняют препаратами ДОКСА, альдостерона, фторгидрокортизона. Они регулируют солевой обмен. При стабилизации процесса проводится подсадка кристаллов ДОКСА (100–125 мг) с учетом, что из трансплантата ежедневно всасывается 0,3 мг препарата. В гормональном лечении дети нуждаются до 2 лет жизни. В дальнейшем состояние компенсации достигается поддерживающей дозой кортизона и 3–4 г поваренной соли. Гормонально-активные опухоли коры надпочечников Гормонально-активные опухоли, в отличие от гормонально-неактивных опухолей коры надпочечников, характеризуются гиперфункцией коры надпочечников. В зависимости от вида продуцируемого гормона они подразделяются на следующие виды: 1) кортикостерома – опухоль, продуцирующая кортизол (в избытке); 2) андростерома – вирилизирующая опухоль коры надпочечников, вырабатывающая андрогены; 3) кортикоэстрома – феминизирующая опухоль, продуцирующая эстрогены; 4) альдостерома – опухоль, продуцирующая альдостерон и обусловливающая развитие синдрома Кона (первичного гиперальдостеронизма); 5) смешанные опухоли коры надпочечников (кортико андростерома, кортико альдостерома). Все больные прибавляют в весе, жалуются на головную боль, сонливость, у женщин появляется гипертрихоз – обильный рост волос на туловище и лице (усы, борода), рано возникают нарушения половой функции (атрофия матки, влагалища), наблюдаются возрастающее артериальное давление, нарушения психики, депрессия, нетерпимость к окружающим. Люди замыкаются в себе, у них появляются суицидальные мысли. Развивается остеопороз. Все перечисленные опухоли коры надпочечника подлежат хирургическому удалению. Своевременное удаление доброкачественной опухоли приводит к выздоровлению. При отсутствии метастазов и радикальном удалении злокачественной опухоли прогноз также достаточно благоприятный. Сахарный диабет Характеристика признаков сахарного диабета впервые встречается в описания заболеваний, о которых несколько тысяч лет назад рассказывали врачи Рима, Греции, Египта, Индии, Китая. Но лишь в 1788 г. Лангерганс пришел к выводу, что причиной возникновения сахарного диабета являются нарушения в поджелудочной железе. А через 100 лет врачи обнаружили в поджелудочной железе островковые клетки непонятного предназначения. И в 1901 г. Л. Соболев подтвердил, что островками Лангерганса осуществляется внутренняя секреция. Через 20 лет из них извлекли инсулин. Оказалось, что 75 % клеточного состава островков Лангерганса специализируется на биосинтезе инсулина. В поджелудочной железе человека содержится примерно 25 мг инсулина. Еще 5 лет ушло на то, чтобы люди научились получать инсулин в кристаллическом виде, а последующие 30 лет – чтобы раскрыть его химическую структуру. Прошло 10 лет, и инсулин стали синтезировать в лаборатории. Его синтез в организме усиливается секретином, тиреоидными гормонами, АНТГ, СТГ, глюкагоном, лейцином, аргинином, рибозой, фруктозой, глюкозой. Синтез инсулина ослабляется различными патологическими состояниями поджелудочной железы. Нарушение биосинтеза, выделения инсулина и его инактивация (чаще обусловленные генетически) приводят к сахарному диабету. С кровью инсулин через воротную вену поступает в печень. Там большая часть инсулина расщепляется. Не инактивированный инсулин частично связывается с белками, частично остается свободным и поступает в кровь. В ткани из крови переходит свободная часть инсулина. Полураспад инсулина происходит за полчаса. Инсулин влияет на все виды обмена веществ во всех органах и тканях. Поступив в ткани, он воздействует на клеточные мембраны, облегчает транспорт глюкозы, аминокислот, жирных кислот, фосфора, калия, натрия. В мышечной ткани инсулин усиливает синтез гликогена в цитоплазме. Патогенез обменных нарушений при сахарном диабете. При недостаточности или отсутствии инсулина клеточные мембраны становятся менее проницаемыми для калия и натрия, фосфора, жирных кислот, аминокислот, глюкозы; замедляются процессы фосфорилирования глюкозы и ее обмена. Снижение гликолиза (расцепления глюкозы) приводит к снижению образования энергетических веществ, необходимых организму для жизнедеятельности и пластических процессов. Усиливается распад жиров и белков, гликогена в печени, скелетных мышц и жировой ткани и активизируется глюконеогенез в печени и почках. В крови увеличивается содержание молочной кислоты, глюкозы, триглицеридов, аминокислот и неэстерифицированных жирных кислот (НЭЖК). Происходит жировая инфильтрация печени. В ней усиливается образование азотистых продуктов распада и из-за неполного окисления свободных жирных кислот увеличивается продукция кетоновых тел – кетогенез. Образуется много холестерина. Накопление этих веществ в крови ведет к развитию комы сопровождающейся нарушением кислотно-щелочного равновесия, увеличением глюкозы в крови, повышеним уровня липидов, калия, холестерина, азота. Головной мозг получает мало глюкозы и кислорода. Его углеводное и кислородное голодание тормозит подкорковые образования (гипоталамические). Импульсами гипоталамуса возбуждаются мозговая часть надпочечников и адренокортикотропная функция гипофиза, усиливающая функции корковой части надпочечников. При отсутствии инсулина увеличивается секреция катехоламинов и глюкокортикоидов. Действие контринсулярных гормонов мобилизует белки и жиры, активизирует гликогенолиз, глюконеогенез и кетогенез в печени. Усиливается гликогенолиз в мышцах, и в кровь поступает излишнее количество молочной кислоты. Отсутствие инсулина немного компенсируется гипергликемией, гиперкетонемией. Гипоталамо-гипофизарная область, надпочечники, симпатический отдел нервной системы в условиях внутриклеточного дефицита энергетических веществ в качестве приспособительной реакции стимулируют организм на обеспечение усиленного образования глюкозы. Это происходит путем усиленного глюконеогенеза из продуктов, полученных при интенсивном распаде белков различных органов и тканей, что физически и иммунобиологически уязвляет организм. Этот механизм приспособительно-компенсаторной реакции на отсутствие инсулина крайне опасен для организма. Он теряет большое количество продуктов распада собственных тканей, обессоливается, обезвоживается. Жизнедеятельность организма в отсутствии инсулина невозможна. Сахарный диабет очень тяжелое заболевание. В доинсулиновую эпоху больные сахарным диабетом погибали. И в настоящее время сахарный диабет у многих больных, несмотря на лечение, быстро и остро прогрессирует. Прогноз заболевания во многом зависит от своевременности его выявления. Поэтому так важно вовремя обратить внимание на характерные для него симптомы: сухость во рту, жажду, повышенный аппетит, одновременное похудание с приступами слабости, пародонтоз, остеопороз, фурункулез, медленное заживление ран и костных переломов, увеличенное отделение мочи. Указанные признаки появляются не все одновременно. Иногда их и вовсе нет, а заболевание выявляется случайно при нахождении сахара в анализе мочи. Имеется определенная генетическая склонность к диабету. Но это совершенно не означает, что если кто-то из предков был диабетиком, то человек обязательно будет страдать сахарным диабетом. Существует много вариантов происхождения скрытых форм диабета: ослабление функций бета-клеток за счет повышенной чувствительности рецепторов желудка к сахару, за чем следуют появление нервно-рефлекторной гипергликемии, повышенная всасываемость глюкозы в кишечнике и нарушение функции печени. Развитие ожирения может способствовать переходу простой формы диабета в клиническую. По течению диабет бывает разных типов.1. Юношеский тип диабета (диабет худых) с абсолютным отсутствием инсулина и тяжелым течением. В основном это заболевания наследственного характера. 2. Тип диабета взрослых (тучных) проявляется в возрасте после 40 лет у лиц с лишним весом. Уровень инсулина в крови либо умеренно повышен, либо понижен. 3. Лабильный диабет, встречающийся у больных юношеским типом заболевания. Дозы инсулина часто меняются. 4. Инсулинрезистентный диабет, характеризующийся суточной потребностью в инсулине 200 единиц и больше. 5. Диабет беременных характеризуется высокой гликозурией и невысокой гипергликемией. Такие больные рискуют иметь потомство с различными эмбриопатиями. 6. Панкреатический диабет как следствие травматизации бета-клеток, кисты, кровоизлияния, склероза, воспалительных процессов, обезвоживания, гемохроматоза и других воздействий. 7. Эндокринный диабет – результат гиперфункции эндокринных желез, продуцирующих избыточное количество контринсулярных гормонов: АКТГ, глюкокортикоидов, катехоламинов, тиреоидных гормонов, СТГ, глюкагона. 8. Ятрогенный диабет – как осложнение побочного воздействия медикаментов (глюкокортикоидов, диуретиков и др.). Для того чтобы выявить причины сахарного диабета, следует учитывать следующие факторы: 1) возраст пациента на момент развития диабета; 2) длительность заболевания; 3) возможные этиологии (наследственность, приобретенность, панкреатичность, гипофизарность); 4) тяжесть диабета; 5) вес больного (излишен ли он и на сколько процентов); 6) состояние различных органов и систем; 7) реакция на диету, физическую нагрузку, сахароснижающие препараты. Основные признаки сахарного диабетаПолидипсия (повышенная жажда) является одним из ведущих симптомом заболевания. Вначале она связана с угнетением функции слюнных желез, отчего иссушивается слизистая оболочка полости рта и глотки, а затем с обезвоживанием организма и обусловлена повышенным содержанием в крови хлористого натрия, глюкозы, мочевины. Полифагия (или чувство голода) связана с усиленным превращением белков и жиров в углеводы. Изменение веса. Падение веса в результате полиурии и гликозурии, несоответствие между калорийностью пищи и энергетическими затратами организма. У части больных вес тела нарастает, если они употребляют избыточное количество пищи при недостаточной физической нагрузке. У них усиленно откладывается жир. При сахарном диабете нередко страдает и пищеварительный аппарат. У больных диабетом, не занимающихся лечением, в первую очередь поражаются зубы (пародонтоз, кариес) и полость рта (перидентальные инфекции, гингивиты). Язык становится красным и сухим. Понижен или отсутствует аппетит. У страдающих диабетом развиваются гастриты, прогрессирующая атрофия железистых элементов желудка, нарушения сосудов слизистой оболочки желудка. С длительностью заболевания более 15 лет развивается диабетическая ангиопатия в желудочно-кишечном тракте. Нарушение обмена веществ сказывается на секреторной функции желудка – угнетается секреция желудочного сока и снижается содержание соляной кислоты в нем. При легком течении диабета секреция желудочного сока не меняется. Диабетики предрасположены к заболеваниям желчевыводящих путей. При диспепсии с рвотой может развиться диабетическая кома (если больные вводят инсулин и допускают погрешности в диете). Диабетическая кома является наиболее грозным осложнением сахарного диабета и характеризуется развитием кетоацидоза – острой декомпенсации обмена веществ, проявляющейся резким повышением уровня глюкозы и концентрации кетоновых тел в крови, появлением их в моче вне зависимости от степени нарушения сознания больного и требующей его экстренной госпитализации. Клинические проявления кетоацидоза начинаются с головной боли, потери аппетита, слабости, подавленности, тошноты, рвоты, сонливости, учащенного дыхания. Часто беспокоят боли в желудке, в ногах. При приближении к коме усиливается рвота и боль в животе. Больной может стать неподвижным и потерять сознание. Лицо у больного красное, осунувшееся. Конечности холодные, температура тела понижена. В анализах выявляется высокая гликемия – 400–100 мг %. Щелочной резерв снижен. В крови повышается содержание остаточного азота. Кровь сгущается, что проявляется лейкоцитозом, повышенным количеством эритроцитов и гематокрита. Наблюдаются миелоидные элементы крови. Отмечается резко положительная реакция на ацетон, высокая гликозурия (выше 4 %). Иногда гликозурия и ацетонурия бывают слегка заметны или их вовсе нет. Это обычно свидетельствует о тяжелом токсическом поражении почек. В моче обнаруживается альбуминурия. Кома – состояние потери сознания с исчезновением рефлексов. При диабетической коме кетоацидоз и гипергликемия резко обезвоживают организм, ведут к потере электролитов, что приводит к сердечно-сосудистой и почечной недостаточности. Сегодня благодаря лечению инсулином и диетой, смерть больных сахарным диабетом от комы наблюдается редко. Больные диабетом стали чаще умирать от сосудистых осложнений. В настоящее время половина больных диабетом погибает от сердечно-сосудистых нарушений: инфаркта миокарда, кровоизлияния в головной мозг, гангрены конечностей, хронической сердечной недостаточности, атеросклероза. Больные диабетом с продолжительностью его в 15–20 лет в 48 % случаев погибают от почечной патологии. Предполагается, что избыток гормонов коры надпочечников может послужить причиной развития диабетической нефропатии. Изучали почки больных красной волчанкой, ревматическим артритом, которых лечили глюкокортикоидами. Изменений в почках не наблюдалось. Значит, сосуды почек, возможно, поражаются до развития диабетического нарушения веществ. У больных предиабетом в почках в центральной межкапиллярной части клубочков было обнаружено вещество, подобное гликопротеиду основной мембраны. У диабетиков с десятилетним стажем электронная микроскопия почек показала увеличение и распространение в них интеркапиллярных веществ. Затем происходит утолщение в 2–3 раза основной мембраны капилляров. По мере прогрессирования процесса в утолщения вовлекаются все капилляры. У 70 % длительно болеющих диабетом в возрасте свыше 50 лет наблюдается гипертония. Для давно страдающих сахарным диабетом характерным являются патологические изменения в сетчатке глаз. Они проявляются микроаневризмами, кровоизлияниями и образованием новых сосудов (пролиферацей). Микроаневризмы могут исчезать, а могут превращаться в белые пятна. Большие кровоизлияния могут распространяться в стекловидное тело, при этом значительно ослабляется или совсем теряется зрение. Дегенерация капилляров вызывает атрофию внутренней области сетчатки. Это так называемая ретинопатия, развивающаяся при диабете. До 40 лет она почти не проявляется. Но у больных 50 – 60-летнего возраста при поражении почек она встречается чаще в 17 раз. При отсутствии поражения почек ретинопатия не прогрессирует. Атеросклероз глазного дна и атеросклероз почек часто сопровождают друг друга. Конечно, способствует развитию ретинопатии и артериальная гипертония. При хорошем контроле состояния болеющих диабетическая ретинопатия развивается у 67 %, а при плохом контроле – у 85 % больных. Плохой контроль означает неаккуратное введение инсулина, перерывы в его введении, нарушение режима приема пищи, несоблюдение рациона, игнорирование гликозурии и гипергликемии, халатное отношение к указаниям врача. Осложнения при этих обстоятельствах проявляются в виде прогрессирующей диабетической ретинопатии. Поражение сосудов нижних конечностейСамое раннее проявление сосудистых расстройств у больных диабетом – атеросклероз сосудов нижних конечностей. Сосудистая недостаточность выражается следующими проявлениями: кожа ног выглядит атрофичной, блестящей; пульсация на тыльной артерии стопы ослаблена; стопы холодные; беспокоят боль, парестезии (жжение, покалывание, чувство онемения); отмечается перемежающаяся хромота. Неряшливое отношение к ногам может провоцировать гангрену пальцев или всей стопы. При диабетической сосудистой недостаточности незначительное повреждение кожи стопы (мозоль, ссадина) может образовать некротические язвы. При диабете часто появляются симптомы поражения периферических нервов: боль в мышцах, зуд, судороги в икрах. В диабетической нейропатии выделяют несколько синдромов. Нарушение чувствительности проявляется ощущениями ползания «мурашек», сопровождающимися болью – щекочущей, колющей. Болевой синдром выражается локализованными мучительными болями (острыми, тупыми, жгучими) в подошве стоп. Днем они слабее, ночью в состоянии покоя усиливаются. Больные ночью не спят, а ходят, так как движение слегка ослабевает боль. У других больных, напротив, движения усиливают боль. Атактический синдром проявляется нарушением глубокой чувствительности, мышечной слабостью. Диабетический полиневрит выражается радикулитами, радикулоневритами, связанными с изменением в позвоночнике. Возникают и нарушения вегетативной иннервации повышенное потоотделение, нарушение кишечной моторики, половой потенции у мужчин. Лечение больных диабетом основано на таких правилах, как: 1) диета; 2) активная мышечная деятельность, рациональный режим труда и отдыха; 3) сахароснижающие препараты. Для лечащих врачей существуют общие принципы: 1) врач обязан убедить пациента, что успех лечения во многом зависит от больного, от того, в какой мере он будет следовать указаниям врача; 2) врач должен разъяснить больному характер заболевания и принцип лечения. Важно предупредить больного, что курение, алкоголь, переедание, избыточный вес и малоподвижный образ ему очень вредны, все это усугубляет диабет; 3) врач должен ознакомить больного с первыми признаками гипогликемического состояния и диабетической комы; 4) желательно научить больного самостоятельно определять сахар в моче, исследовать гликозурию, сопоставлять ее с количеством и качеством принимаемой пищи; 5) врач должен научить разбираться в таблице пищевых продуктов и содержании в них углеводов, белков, жиров и витаминов; заменять одни продукты другими, не изменяя положенного ему количества различных составных частей пищи; 6) врач обязан позаботиться о сохранении или восстановлении работоспособности больного диабетом, о снижении веса у тучных и прибавлении его у истощенных; 7) врач должен разработать доступную систему физических упражнений; 8) врач должен леченить на предотвращение или замедление выраженности сосудистых осложнений. ДиетотерапияДиета больных диабетом благодаря инсулину расширена. Соотношение жиров, белков, углеводов нормальное, по калорийности не превышающее 3500 ккал. Важно, чтобы диабетики получали пищу не 2–3 раза в день, а 4–5 раз через каждые 3 ч. Предпочтительны продукты, содержащие медленно усваивающиеся углеводы (черный хлеб, гречневую, овсяную каши, картофель). Можно употреблять молоко, творог, нежирные сорта мяса, рыбы, яичный белок. Сливочное масло разрешается до 40 лет, после – 2/3 количества жиров должно быть представлено растительным маслом. Витамины необходимы в большом количестве и желательно в натуральном виде (в овощах и фруктах). Из рациона исключаются продукты, содержащие легкоусваиваемые углеводы: сахар, конфеты, мед, варенье, шоколад, манная крупа. Резко ограничиваются рис, белый хлеб (см. табл. 1). Таблица 1Диабетические диеты, предложенные С. Г. Генесом и Е. Я. Резницкой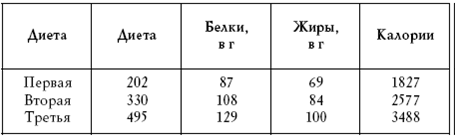 Первая и вторая диеты назначаются детям до 10 лет. С 11–16 лет – только вторая. Третья диета назначается истощенным взрослым. Большинству взрослых лучше подходит вторая диета. Учеными подсчитана затрата килокалорий в час: на постельное пребывание – 20–25, на сидячую работу – 25–30, на работу умеренной тяжести – 30–35 и тяжелую работу – 40–50. В диете взрослых и больных диабетом количество белков не должно быть меньше 1–1,5 г, а при физических нагрузках – 2 г, жиров – 0,75 – 1,5 г, углеводов – 3–4 г, реже 5 г на 1 кг расчетного веса. При подборе следует учитывать географические особенности проживания больного и материальные возможности. Значительную часть углеводов можно принимать с овощами и фруктами. Адекватная замена одного продукта другим учитывает, к примеру, что 20 г хлеба (13 г углеводов) адекватно 15 г пшеничной или кукурузной муки, 18 г сухих или 65 г вареных макарон, 250 г молока, 350 г кислого молока или простокваши, 60 г картофеля – 20 г сухого или 70 г вареного гороха, фасоли или чечевицы, 130 г слив – 135 г черешни или вишни, 140 г яблок или груш – 170 г апельсинов, 190 г арбуза, 210 г земляники или черники (см. табл. 2). Таблица 2Примерное меню диеты (в граммах), содержащей 2600 калорий (углеводов 332 г, белков 91 г, жиров 66 г)  Для снижения избыточного веса больным диабетом назначается гипокалорийная диета: 1200 калорий для женщин и 1500 калорий для мужчин. Состав диеты: 200–250 г мяса или рыбы, 200–300 г творога, 50 мл молока, 5 – 10 г масла, 50 г хлеба, 100 г картофеля, до 1000 г овощей и до 300 г несладких фруктов в день. Мышечная деятельность в комплексе лечебных мероприятий. Мышечная работа тонизирует мускулатуру, улучшает кровообращение во всем организме, укрепляет сердечную мышцу, нормализует эластичность и реактивность периферических сосудов, предотвращает и накопление избыточного жира, повышает иммунную систему. Обеспечивается мышечная деятельность энергией окисления углеводов и жирных кислот, используются сначала собственные запасы углеводов в мышцах. Образующаяся в них молочная кислота увеличивает просвет капилляров, облегчая тем кровоток. Возбуждается симпатико-адреналовая система. Увеличивается выделение адреналина и норадреналина, и усиливается гликогенолиз в печени и в мышцах. В кровь поступает глюкоза, способствуя «первичной рабочей гипергликемии».  У больных диабетом постоянная мышечная деятельность усиливает утилизацию мышцами углеводов и жирных кислот. Но физическую работу они должны выполнять после введения инсулина. Диабетикам лучше выполнять спокойную, плавную, ритмичную работу. Систематически выполняемая физическая работа приводит к возможности уменьшения дозы инсулина. И тем больным, у которых уже есть нарушения периферического кровообращения, полезна гимнастика. Не повредит она и лежачим больным. Сахароснижающие препаратыВсе эти препараты быстро всасываются в кишечнике и поступают в кровь. Они повышают чувствительность бета-клеток к гликемии и оказывают потенцирующее влияние на инсулиновый эффект. Эффект достигается быстрым освобождением инсулина из связи его с белками крови. 40 % больных диабетом пользуются сахароснижающими сульфаниламидами. Они не оказывают повреждающего действия на бета-клетки, печень и почки, а также на сердечно-сосудистую и нервную системы. К применению сульфаниламидных препаратов есть противопоказания: тяжелый диабет взрослых, наличие ацидоза, кетоза, прекома, кома, хирургические операции, инфекции, гангрена, травма, беременность, почечная гликозурия, гипергликемия, связанная с уремией (см. табл. 3, 4). Таблица 3Основные сахароснижающие сульфаниламидные препараты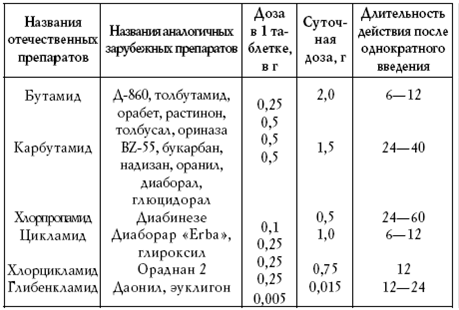 Таблица 4Бигуаниды Таблица 4Бигуаниды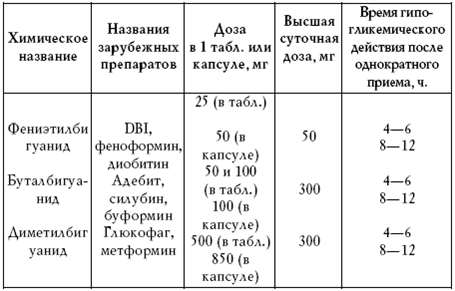 Применение бигуанидов показано прежде всего при диабете в сочетании с ожирением. Противопоказания для использования бигуанидов те же, что и для сульфаниламидов. ИнсулинотерапияСоздание лечебных препаратов инсулина круто изменило судьбу миллионов больных сахарным диабетом и, несомненно, является одним из самых замечательных достижений медицины ХХ в. В то же время инсулинотерапия не идеальна, потому что не уподобляется ритму секреции инсулина поджелудочной железой. Никто не знает, сколько она секретирует инсулина при приеме пищи у конкретного человека. Больным приходится пользоваться лишь приблизительным количеством инсулина. Кроме того, инъекции инсулина болезненны. Применение инсулина показано при средней тяжести и тяжелом диабете. При кетоацидозе, выраженной декомпенсации заболевания с высокой гипергликемией и гликозурией; истощении больного; невозможности компенсировать углеводный обмен диетой и пероральными сахароснижающими препаратами; детском и юношеском диабете (см. табл. 5). Таблица 5Характеристика сахароснижающего действия различных видов инсулина Для рационального лечения инсулином необходимо учитывать индивидуальные особенности каждого больного и свойства различных препаратов инсулина. Для уточнения дозировки всех видов инсулина определяют суточное количество сахара в моче (моча собрана с 9 до 14 ч., затем за следующие 5 ч., за 4 последующих, далее за период с 23 ч. ночи и до 6 ч. утра, потом до 9 ч. утра). Согласуясь с полученными данными, устанавливают соответствующую дозу инсулина, частоту инъекций, количество принимаемых углеводов в различное время, а по необходимости назначают дополнительное введение простого инсулина. Инсулин длительного действия противопоказан диабетикам с тяжелой формой заболевания, выраженным кетоацидозом, а также в состоянии прекомы и диабетической комы. Препараты инсулина хранят в темном, прохладном месте и не замораживают. К абсолютной инсулинорезистентности относят случаи, когда для компенсации обменных нарушений требуется больше 200 ЕД инсулина в сутки. Причиной снижения чувствительности к инсулину может быть гиперпродукция контринсулярных гормонов, что бывает при акромегалии, болезни Иценко – Кушинга, опухолях надпочечников. Порой потребность в инсулине возрастает при травмах, инфекциях, хирургических вмешательствах. Трудности возникают при лечении идиопатической инсулинорезистенции из-за образования антител к вводимому инсулину. С целью подавления их вместе с инсулином назначают преднизолон до 15–30 мг в сутки в течение 2–3 недель с постепенным снижением дозы. Часто при введении инсулина наблюдаются аллергические реакции в виде покраснения и уплотнения на месте инъекции, кожной сыпи и даже анафилактического шока. Тогда заменяют препарат инсулина другим, добавляют антигистаминные препараты (димедрол, пипольфен и др.). Реже прибегают к глюкокортикоидам. Для профилактики осложнений планомерно меняют точки инъекций. Критерии эффективности лечения больных сахарным диабетом.1. Самый важный критерий эффективности лечения – нормализация веса. У тучных диабетиков потребность в инсулине повышена. 2. Нормализация веса улучшает общее самочувствие больного. Устраняются слабость, утомляемость. 3. Систематические занятия физкультурой, пребывание на свежем воздухе, устранение клинических признаков диабета восстанавливают работоспособность. 4. Нормализация сопротивляемости организма к различным повреждениям. 5. Хотя бы частичное устранение сопутствующих и осложняющих диабет заболеваний облегчает течение основной болезни. 6. Необходимым является своевременное предупреждение инсулиновых гипогликемий и кетоацидоза. 7. Достижение агликозурии или минимальной гликозурии (10–15 г сахара в суточной моче, но не более 5 % количества углеводов пищи). 8. Достижение нормальной гликемии, которая не вызывает глюкозурию (см. п. 7). 9. Ослабление проявлений ангиопатий. Предупреждение развития сахарного диабетаДиабет часто возникает после физической, а еще чаще – после психической травмы. Многие становятся диабетиками в результате первичного поражения поджелудочной железы при травме живота, появления в железе камней, кист, кровоизлияний; удалении большой части поджелудочной железы в связи с новообразованием или некрозом; при остром, хроническом, рецидивирующем панкреатите, гемохроматозе, склерозе сосудов железы и при других нарушениях функций желудочно-кишечного тракта и печени. Все эти варианты недомоганий способны значительно повредить бета-клетки. Важно своевременное лечение первых признаков ослабления их функции. Сахарный диабет может обнаружиться вскоре после перенесенных инфекционно-токсических заболеваний. Опасно длительное общее голодание, которое способно атрофировать бета-клетки инсулярного аппарата поджелудочной железы. Гипогликемия и гипогликемический симптомокомплекс Снижение уровня сахара в крови ниже физиологической нормы (2,75 ммоль/л или 50 мг %) – это гипогликемия. Все органы и ткани в организме нуждаются в глюкозе. Головной мозг удовлетворяет свои энергетические потребности исключительно за счет глюкозы. Организм получает глюкозу с углеводами пищи. Это они превращаются в глюкозу в желудочно-кишечном тракте и печени. Часть глюкозы в виде гликогена остается в печени, остальная уходит в кровь. Печень поддерживает нормальный уровень сахара в крови, так как, реагируя на уменьшенный приток к ней сахара, сама увеличивает его выделение в кровь. Свойство печени увеличивать и уменьшать выделение сахара называется гомеостатическим (ауторегуляторным). Пониженный уровень сахара в крови возбуждает гипоталамус, его ядра, связанные с симпатическими нервами. Они усиливают в печени гликогенолиз и секрецию мозговой частью надпочечников адреналина и норадреналина. Они также стимулируют гликогенолиз в печени. В организме заложены мощные механизмы, обеспечивающие усиленную выработку глюкозы в случае уменьшения гликемии. Условия для развития гипогликемии создаются, если эндокринные железы, вырабатывающие гормоны, ослаблены или ферменты в печени повреждены. Избыточное поступление инсулина у больных сахарным диабетом тоже вызывает гипогликемию. Механизм развития инсулиновых гипогликемийИнсулин ослабляет поступление глюкозы из печени в кровь из-за угнетения гликогенолиза и перехода глюкозо-6-фосфата в глюкозу в результате угнетения глюкозо-6-фосфотазы. Инсулиновая гипогликемия нарушает функции всех органов и тканей. Усиление гликогенолиза печенью обедняет саму печень гликогеном. В ней нарушается синтез макроэргов и белка, расстраивается антитоксическая функция. Гипогликемия замедляет переход глюкозы в скелетные мышцы и миокард. Функция мышц ослабляется. Наиболее сильное влияние гипогликемия оказывает на центральную нервную систему. Гипогликемический симптомокомплексГипогликемический синдром развивается у людей и животных при уменьшении концентрации сахара в артериальной крови ниже критического уровня. При снижении его до 70 мг % появляются страх, дрожание конечностей, общая слабость, чувство голода. При 70–50 мг % сахара в крови отмечаются пот на висках, бледность, испуг, нарушается координация движений, затуманивается сознание. При дальнейшем снижении сахара в крови больной впадает в кому. Гипогликемический симптомокомплекс у людей с различными заболеваниями проявляется по-разному, так как различные патологические состояния организма видоизменяют его картину. Несмотря на разнообразие этих клинических проявлений, объединяет их основной симптом, развивающийся на протяжении всего цикла, – это нарастание сонливости. Характерна фазовость развития гипогликемического синдрома. Первая фаза начинается обычно через 2 ч. после введения инсулина и проявляется чувством слабости, адинамии, легкой сонливости, торможением двигательных и словесных реакций, колебанием артериального давления, потливостью, чувством голода и жажды, ознобом. Вторая фаза выражена нарастанием сонливости. Развивается глухота. Нарушается речь, она становится сбивчивой, появляются зрительные галлюцинации, псевдогаллюцинации, изменяется восприятие времени, могут быть психомоторные возбуждения. При переходе в третью фазу наблюдаются судороги, активизируется симпатическая нервная система, что проявляется экзофтальмом, тахикардией. Глубокая гипогликемия нарушает функции черепно-мозговых нервов: глазодвигательного, тройничного и лицевого. Четвертая фаза характеризуется выключением коры головного мозга и торможением подкорковых образований (кома). При углублении комы наступают выраженная мышечная гипотония, расстройства дыхания и сердечной деятельности. Гиперинсулинизм (инсулома)Различные заболевания поджелудочной железы вовлекают в патологический процесс бета-клетки. Гиперплазия их может быть следствием злокачественной опухоли головки поджелудочной железы, отчего закрываются ее выводные протоки. И больной страдает приступами гипогликемии. Опухоли инсулярного аппарата продуцируют большое количество инсулина. Клиника: больной слабеет, охвачен чувством беспокойства, быстро утомляется или возбуждается, бредит, раздражается без повода, сильно потеет, дрожит, у него кружится голова, он может потерять сознание. Часто такой приступ сопровождается характерными для эпилептического припадка явлениями, после чего больной впадает в кому. У многих больных в начале приступа гипогликемии появляются чувство онемения в различных частях тела, головная боль, тошнота, слабость, потливость. После приступа больной обо всем этом забывает. Но если приступы учащаются, то поражается кора головного мозга. Это проявляется ухудшением памяти, раздражительностью, апатией, эмоциональной неустойчивостью, дезориентацией, часто галлюцинациями и навязчивыми идеями. Обычно эти симптомы проявляются утром натощак и исчезают после приема пищи, но могут повторяться спустя несколько часов. Половина больных во время приступов теряет сознание. Приступы устраняются введением легкоусвояемых углеводов, внутривенным вливанием глюкозы. Сознание восстанавливается, но больной остается дезориентированным, сонным и суетливым. Лечение инсуломы. Лечение заключается в удалении опухоли. Но после операции часто появляется сахарный диабет. Как известно, он связан с угнетением нормальных островков Лангерганса в условиях гиперфункции инсулина опухолью. Но через 2–3 недели диабет исчезает. После удаления инсулом гипогликемические приступы исчезают. Но симптомы, свидетельствующие о повреждении мозга, поскольку они уже возникли в период инсуломы, остаются. Инсулома может быть вне поджелудочной железы: в кишечнике, желудке, желчном пузыре. Удаление инсуломы прекращает приступы гипогликемии. При неоперабельности больных злокачественной инсуломой им назначают белково-жировую диету: дробное питание через каждые 2–3 ч. Так предупреждается гипогликемия. Спонтанная гипогликемияУ опухолевых больных часто наблюдается гипогликемия. На ее развитие вследствие выделения фибросаркомой в грудной полости инсулина указывают многие эндокринологи. После удаления фибросаркомы инсулиновая активность нормализуется. При патологии печени также бывает гипогликемия. Симптомы гипогликемии наблюдаются при травме мозга, субарахноидальном кровоизлиянии, прогрессивном параличе, сильной психотравме, при повреждении гипоталамуса или мозгового ствола опухолью, воспалением, травмой. У астеников, эмоционально нестойких людей может развиться спонтанная гипогликемия. По-видимому, симптомы гипогликемии стимулируются вегетативными реакциями, вызываемыми психогенными причинами. Гипогликемический симптомокомплекс может настичь человека без всякой видимой причины и других признаков заболеваний в любое время дня. Человек внезапно бледнеет, доходит до обморочного состояния без судорог. Спонтанная гипогликемия встречается среди печеночных больных, опухолевых, длительно голодающих, алкоголиков. Ряд ученых считают, что эта гипогликемия является результатом повышенной чувствительности бета-клеток к нормальным раздражителям. Люди, склонные к такому заболеванию, эмоционально неуравновешенны, возбудимы и очень реактивны. Но у них не происходит повреждение мозга и других органов. Спонтанная гипогликемия часто развивается в отсутствие каких-либо заболеваний, кроме нервных. Гипогликемические явления следует учитывать для срочного определения гликемии. Если нет возможности определить уровень сахара в крови, то больному следует принять внутрь углеводы. Употребление сладкого ликвидирует симптомы гипогликемии. К сожалению, к такому простому способу люди чаще не догадываются прибегать, а тем более определять гликемию химически. л Люди с указанной симптоматикой живут годами, впадая неоднократно в состояние гипогликемии и не получая медицинской помощи. Смерть при длительном и глубоком гипогликемическом приступе наступает редко. Организм мобилизует контринсулярные механизмы. Заболевания половых желез Половая система представлена половыми железами (гонадами) и добавочными (вспомогательными) половыми органами. У мужчин к ним относятся семенники, семявыводящие пути, семенные пузырьки, предстательная железа и половой член; у женщин – яичники, фаллопиевы трубы, матка, влагалище, наружные гениталии. К женской половой системе относятся и молочные железы. Во взрослом организме активаторами половых функций являются гонадотропные гормоны передней доли гипофиза – фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ). Деятельность женской половой сферы протекает циклически. Семенники функционируют постоянно. У особей мужеского пола передняя доля гипофиза выделяет ЛГ непрерывно, в женском организме интенсивность секреции периодически меняется. Гормоны яичников. Секреция, биологическое действие. Эстрогены. Эти гормоны обладают широким спектром влияния на организм. Общим для них является свойство вызывать течку у животных – эструс. Эстрогены образуются в яичниках – в интерстициальных клетках и внутренней оболочке фолликулов. Из места своего образования эстрогены поступают в кровь. В ней они расщепляются, поступают в органы и ткани, подвергаются влиянию различных ферментов. Часть эстрогенов соединяется с белками, часть связывается в печени с глюкуроновой и серной кислотой. Образовавшиеся глюкурониды и сульфаты становятся водорастворимыми и поступают в желчь, а с ней – в кишечник. Часть из них выделяется с калом, часть – с мочой. Эстрогены способствуют развитию женских половых органов и вторичных половых признаков, оказывая биологическое влияние на влагалище, матку, яичники, наружные гениталии (возникает набухание), молочные железы, гипофиз, центральную нервную систему, поджелудочную железу. Прогестерон – важный гормон, обладающий гестагенным действием. Он образуется в желтом теле, плаценте, коре надпочечников и семенниках. В крови прогестерон циркулирует в связи с белками. В печени он превращается в прегнандиол и, соединившись с глюкуроновой кислотой, выделяется из организма с мочой. Прогестерон прекращает действие эстрогенов на слизистую оболочку матки в менструальном цикле: прекращается ее пролиферация, и наступает фаза секреции. Прогестерон – важный фактор нормального развития беременности. Прогестерон снижает интенсивность и может предотвращать маточные кровотечения, вызываемые увеличенным количеством эстрогенов. У части женщин в фазе увеличения количества эстрогенов в организме повышается сексуальность, в прогестероновой фазе понижается. Андрогены – еще одна разновидность гормонов, образующихся в яичниках, основным из которых является тестостерон. Часть тестостерона образуется из андростендиона коры надпочечников. Нормальные женщины выделяют с мочой 5 % количества тестостерона. Увеличенное количество андрогенов продуцируется при склерокистозе и опухолях яичников. Релаксин – гормон, секретирующийся плацентой и яичниками, обнаруживается в крови у женщин во время беременности. Релаксин расслабляет тазовые связки и связки лонного сочленения, релаксирует шейку матки, благодаря чему обеспечивается физиологическое течение родов. Менструальный цикл – регулярно повторяющиеся маточные кровотечения у женщин, теряющей в этой период 50 – 100 мл крови. Кровотечение продолжается не более 5 дней. Длительность менструального цикла составляет в среднем 28 дней, иногда 21 день, у некоторых (у 10 % женщин) цикл укладывается в 30–35 дней. Во время менструации отторгается верхний слой эндометрия (функциональный слой) и кровотечение идет из вскрытых сосудов. От эндометрия сохраняется его нижняя часть – базальный слой, в котором остаются концы (донышки) маточных желез. В постменструальной фазе рост слизистой оболочки матки стимулируется эстрогенами, продуцирующимися растущими фолликулами. Рост очередного фолликула в яичниках продолжается до 14-го дня после начала менструации. Он достигает стадии зрелого граафова пузырька. Лопнувший граафов пузырек превращается в желтое тело, и яичник начинает продуцировать прогестерон. Он активирует секрецию маточных желез. Эндометрий, набухая с притоком крови, увеличивается в толщину. Нарастает содержание гликогена. Маточные железы вырабатывают слизь. Если оплодотворение не произошло, то наступают менструации, совпадающие с окончанием секреции прогестерона. Действительно, инъекциями экзогенного прогестерона удается задержать начало менструации. Самопроизвольный аборт вызывается часто недостаточностью деятельности желтого тела, которая может быть компенсирована введением прогестерона извне. Зародыш имплантирован в толщу слизистой оболочки матки. Наступление аборта означает прекращение действия прогестерона. Это влечет за собой отделение эндометрия и отрыв функционального слоя от базального. Менструация представляет собой аналог родового акта неоплодотворенного яйца. Нарушения менструального цикла. Дезорганизацию стройной системы нейроэндокринной корреляции, приводящей к нарушению менструальной функции, могут вызвать воспалительные заболевания женской половой сферы, интоксикации, инфекции (туберкулез), эндокринные сдвиги, заболевания нервной системы, расстройства сердечно-сосудистой системы и функции печени, заболевания крови и другие патологические факторы. Причиной менструальных расстройств могут быть доброкачественные и злокачественные новообразования матки, яичника, надпочечников, гипофиза, травмы тазовых костей, гипоавитаминозы, недостаточность питания. Кроме того, сбой менструальных циклов вызывают психические потрясения (катастрофы, потеря близких), профессиональные вредности (вибрация, облучение), чрезмерный физический труд. Причинные факторы нарушения менструального цикла устанавливает врач и назначает гормональную терапию с целью нормализации менструальной функции в комплексе с другими методами лечения сопутствующих причинных заболеваний. Аменорея – физиологическое явление, когда менструаций не было или были, но прекратились. Маточная форма аменореи возникает вследствие поражения органа – травмы рецепторов матки (в результате аборта, ручных обследований, воспалительных процессов). Овариальная форма аменореи как физиологическое явление развивается на фоне гипофункции яичников вследствие их недоразвития. Матка остается инфантильной. Вторичные половые признаки слабо развиты. Имеет место бесплодие. Гипофункциональное состояние яичников часто является следствием патогенетических факторов (инфекции, интоксикации, туберкулеза). Аменорея развивается на почве недостаточности эстрогенной функции или железисто-кистозной гиперплазии слизистой матки. Гипофизарно-гипоталамическая форма аменореи возникает вследствие патологического состояния организма психогенной природы, как то: нервно-психическая травма, тяжелые переживания, умственное переутомление, диэнцефальные нарушения. Гормональная терапия, полноценное питание, витамины, физиотерапевтические процедуры – основные компоненты комплексного лечения. Назначают средства, стимулирующие деятельность остатков желез эндометрия. Эстрогены, активизирующие матку, способствуют сохранению физиологической реакции эндометрия. Из гормональных средств лечения аменореи наибольшее применение нашли метилэстрадиол и этинилэстрадиол, выпускающиеся в масляных растворах; натуральные эстрогены: фолликулы, эстрадиол пропионат; синтетические эстрогенные гормоны: синестрол, диэтилстильбэстрол, окэстрол, этинилэстрадиол, прогестерон. Дозы устанавливает врач. Климактерический синдром – это возрастная перестройка высших вегетативных центров с последующим нарушением циклической гонадотропной деятельности гипофиза и циклической деятельности яичников с прекращением овуляции и репродуктивной способности организма. В периоде климактерия происходит нейрогормональное расстройство, обусловленное возрастными изменениями центральной нервной системы, гипоталамуса, гипофиза, яичников и других эндокринных желез. Снижение экскреции эстрогенов происходит после двухлетней менопаузы. Изменяется гонадотропная функция гипофиза. Выделение прегнандиола находится на низком уровне. Е. И. Кватер делит на три категории изменения, характерные для климактерического синдрома: 1) прямое следствие резкого уменьшения в крови эстрогенов (приливы к лицу, шее, груди, иногда по всему телу); 2) изменения вследствие нарушения гормонального баланса и функции гипофизарно-гипоталомического комплекса (головная боль, плохой сон, общая нервозность, страхи, ожирение); 3) развитие интеркурентной патологии, такой как гипертония, сахарный диабет. Глава 4 Последствия лечения гормонами. Как предотвратить катастрофу?  Заболевания, требующие лечения гормонами, в настоящее время не редкость. Но не всегда прием препаратов приводит к полному излечению, ведь последствия могут оказаться плачевными. У гормоносодержащих лекарств есть противопоказания и побочные действия, которые могут возникнуть вследствие того, что тот или иной тип гормонов может просто-напросто не подходить какому-либо органу. Случалось ли вам после приема определенного лекарства чувствовать себя некомфортно. Бывало ли так, что таблетка или инъекция вызывала реакции организма, о которых написано на листке-вкладыше в разделе «Побочные действия». А всегда ли при выборе лекарственных средств врачи учитывают индивидуальные особенности организма своего пациента. Наиболее точные и верные ответы на эти и многие другие вопросы может дать наш с вами организм. Поэтому у него и спросим. Итак, к чему приводит гормональная терапия и как следует лечиться, чтобы потом «не было мучительно больно»? Во-первых, в настоящее время предложен огромный спектр гормональных препаратов, но все же самыми основными в лечении эндокринных заболеваний принято считать андрогенные, гестагенные (прогестины), эндрогенные препараты, а также их антагонисты – тамоксифен, флютамид и т. д. Помимо этого множества, существуют также препараты негормональные, но по своим свойствам очень близкие к ним. Побочные действия тут объясняются очень легко: препарат способствует торможению развития опухоли, но наряду с этим оказывает влияние и на другие органы и ткани. При пересадке костного мозга и аллотрансплантации органов (пересадка здоровых органов умершего донора) используются некоторые препараты глюкокортикостероидов. К примеру, гормональные препараты пагубно влияют на кроветворные органы, поэтому во время курса лечения необходимо постоянное регулирование доз препарата лечащим врачом. Наиболее часто встречающимися побочными действиями можно считать снижение аппетита, диарею, а в некоторых случаях – даже облысение. Оказывается, гормоны андрогены, эстрогены, их аналоги и антагонисты могут стать причиной гормонального расстройства, за которым могут последовать не совсем гормональные заболевания. К сожалению, многие из нас, покупая в аптеке лекарственные препараты, редко заглядывают в инструкции-вкладыши. Поэтому в этой главе мы попытаемся описать хотя бы некоторые гормональные препараты из огромного предложенного в аптеках спектра. Гормоны, их аналоги и антигормональные препараты АНАБОЛИЧЕСКИЕ СТЕРОИДЫ Тестостерон и его аналоги относятся к анаболическим стероидам. В чистом виде принимать их не совсем полезно, так как они обладают сильным андрогенным действием. В связи с этим разработаны синтетические препараты, ничем не уступающие своим аналогам по воздействию, но имеющие избирательную активность. Анаболики способны восстанавливать в организме синтез белков, воздействуют на азотистый обмен, снижают выделение мочевины почками. Благодаря им в организме задерживаются такие микроэлементы, как сера, фосфор, калий, в костях фиксируется кальций. Препараты, включенные в группу анаболиков, различны не только по продолжительности и силе воздействия, но и по андрогенной активности. При применении анаболических стероидов восстанавливается структура костей в случаях остеопороза, увеличивается масса тела, повышается аппетит, наблюдается общее улучшение состояния. Препараты должны применяться в сочетании с полноценным питанием, необходимым количеством витаминов и микроэлементов. Ниже приводится ряд анаболитических лекарственных средств: МЕТАНДРОСТЕНОЛОН, ФЕНОБОЛИН, РЕТАБОЛИН, СИЛАБОЛИН, МЕТИЛАНДРОСТЕНДИОЛ. Мы приводим только краткое описание одного из них. МЕТАНДРОСТЕНОЛОН – синтетический гормональный препарат – анаболический стероид, по действию на организм близок тестостерону, аналогом которого он является, активно применяется в эндокринной, педиатрической и терапевтической практике. Выпускается в виде мазей и таблеток, длительность приема препарата устанавливается лечащим врачом и зависит от разновидности и запущенности заболевания, при этом учитывается пол и возраст человека. Назначается при кахексии различного происхождения, астении, инфекционных заболеваниях с нарушением белкового обмена, после тяжелых травм, операций, ожогов. Показаниями к применению также являются эндокринологические заболевания, такие как хроническая недостаточность надпочечников, межуточно-гипофизарная недостаточность, токсический зоб, ретино– и нефропатия, стероидный диабет, нанизм (гипофизарная карликовость). Терапевт назначает метандростенолон при миокардитах, инфаркте миокарда и хронической коронарной недостаточности, ревматических поражениях сердца и атеросклеротическом кардиосклерозе, перенапряжении миокарда, при хронических язвенных заболеваниях почек, сопровождающихся потерей белка, азотемией, при язвенной болезни желудка и двенадцатиперстной кишки и хронических заболеваниях легких. Препарат применяется и при прогрессирующей миопии и старческой дегенерации сетчатки, экземе, псориазе, остеопорозе, больших переломах и после пластических операций на костях, при замедленном образовании костной мозоли, при миопатиях и прогрессирующей мышечной дистрофии; боковом амиотрофическом склерозе. А в детском возрасте его назначают при задержке роста, упадке аппетита, анорексии. Дерматологи выяснили, что мазь на основе 0,5 % метандростенолона обладает восстановительными функциями при поредении волос или облысении на фоне сухой себореи. Препарат имеет ограниченное время применения, так как вызывает побочные явления: избыточное отложение кальция в костях и задержку их роста, увеличение печени, желтуха, диспепсические расстройства, отеки. У женщин могут проявиться нарушения менструального цикла, огрубение голоса, усиление роста волос по мужскому типу. Длительное беспрерывное применение метандростенолона, равно как и других анаболических стероидов, может привести к осложнениям. Лечение метандростенолоном должно проводиться под тщательным наблюдением врача. Метандростенолон, как и другие анаболические стероиды, должен назначаться после точного установления диагноза заболевания и исключения зависимости анорексии и потери массы тела от заболеваний, требующих специальных методов лечения. Препарат противопоказан при раке предстательной железы, остром и хроническом простатите, острых заболеваниях печени, во время беременности и лактации. Мазь не следует также применять при новообразованиях на коже головы. Действие других препаратов этой группы аналогично действию метандростенолона, различие между ними лишь в более высокой или низкой андрогенной активности. Поэтому мы не будем останавливаться на них. Гормоны гипофиза и их производные Перечень препаратов, оказывающих влияние на восстановительные функции гипофиза, каждый год пополняется. Нужно отметить, что каждый натуральный препарат гормонов гипофиза имеет определенный срок хранения и требует определенного температурного режима. Очень важно после приобретения препарата заглянуть в аннотацию, чтобы не принимать впоследствии испорченное лекарство. КОРТИКОТРОПИН рекомендуется сохранять при температуре не выше +2 °C в сухом, защищенном от света месте. СУСПЕНЗИЯ ЦИНК-КОРТИКОТРОПИНА должна храниться в сухом, защищенном от света месте при температуре от +1 до +1 °C, замораживание препарата не допускается. СОМАТОТРОПИН хранится в сухом месте при температуре не выше +1 °C. ГОНАДОТРОПИН ХОРИОНИЧЕСКИЙ хранится в защищенном от света месте при температуре не выше +2 °C. ГОНАДОТРОПИН МЕНОПАУЗНЫЙ хранится в сухом, защищенном от света месте при температуре не выше +2 °C. ЛАКТИН – в сухом, защищенном от света месте при температуре от +15 до +2 °C. ДАНАЗОЛ – в сухом, защищенном от света месте. ИНТЕРМЕДИН – в темном месте при температуре от +15 до + 17 °C. АДИУРЕКРИН – в прохладном, защищенном от света месте. АДИУРЕТИН СД – нет определенных режимов хранения. ОКСИТОЦИН – в прохладном, защищенном от света месте. ПИТУИТРИН – в защищенном от света месте при температуре от +1 до +1 °C. Кортикотропин получают из гипофиза крупного рогатого скота, свиней и овец. Это препарат антиаллергического и противовоспалительного действия; оказывает влияние на протекание обменных процессов (углеводного, белкового и т. д.) в организме; иммунодепрессант, приводит к отмиранию соединительной ткани. До недавнего времени препарат применялся при лечении бронхиальной астмы, инфекционных полиартритов, нейродермита, острого лейкоза, ревматизма, экземы и т. д. Но с развитием науки было выяснено, что более мягкое воздействие при таком же эффекте оказывают глюкокортикоиды и нестероидные препараты. Длительное применение кортикотропина нежелательно, так как это может вызвать истощение коры надпочечников. При приеме кортикотропина длительное время и в больших дозах могут возникнуть негативные последствия. К ним относятся тахикардия, возбуждение, бессонница и другие нарушения деятельности ЦНС, задержка в организме воды с развитием отеков и повышением артериального давления, нарушения менструального цикла. Увеличивается период восстановления слизистой оболочки желудочно-кишечного тракта при изъязвлениях. Могут возникать обострения скрытых очагов инфекций; проявляться симптомы сахарного диабета, у детей возможно торможение роста. Противопоказан прием препарата при таких заболеваниях и состояниях, как тяжелые формы гипертонической болезни и болезни Иценко-Кушинга, беременность, недостаточность кровообращения III стадии, острый эндокардит, психозы, нефрит, остеопороз, язвенная болезнь желудка и двенадцатиперстной кишки, недавно перенесенные операции, сифилис, активные формы туберкулеза, сахарный диабет, аллергические реакции на препарат. ОКСИТОЦИН. Как уже известно, окситоцин – пептидный гормон задней доли гипофиза. Благодаря современным разработкам, гормон получают синтетическим путем. (О функциях гормонов можно прочитать в главе 2 «Гормональный фон и его изменение в течение жизни».) Как и все лекарственные препараты, окситоцин можно применять только по назначению лечащего врача с учетом индивидуальной чувствительности. Применяется он при родовспоможении (стимуляция и вызов родов). Однако в случае различного рода отклонений в развитии и положении плода, рубцов на матке, малых размеров таза препарат противопоказан, так как способен вызывать сильные сокращения мышц матки. ПИТУИРИН – по своему действию он сходен с окситоцином, имеются только небольшие различия. Питуитрин – натуральный препарат, который получен из задней доли гипофиза крупного рогатого скота. Это препарат, в состав которого входят два действующих вещества – окситоцин и вазопрессин (питрессин). О действии окситоцина мы говорили выше, вазопрессин же вызывает сужение капилляров и повышение артериального давления, оказывает воздействие на канальцы почек. Противопоказаний у питуитрина достаточно много. Это выраженный атеросклероз, гипертоническая болезнь, миокардит, сепсис, тромбофлебит, проблемы с почками у беременных. Его следует исключить при патологическом развитии беременности. В больших дозах и при быстром введении питуитрин может вызвать коллапс, нарушения гемодинамики, спазм сосудов головного мозга. СОМАТОТРОПИН – это натуральный гормон передней доли гипофиза человека. В настоящее время препарат получают способами генной инженерии. Он применяется для восстановления клеток организма, лечения различного рода нарушений, происходящих из-за недостатка гормона роста (это гипофизарный нанизм и гипофизарная карликовость). При применении соматотропина могут возникать аллергические кожные реакции (зуд, кожная сыпь, дерматиты). В этих случаях препарат сразу же заменяют другими лекарственными средствами. При злокачественных опухолях он полностью противопоказан. ГОНАДОТРОПИН ХОРИОНИЧЕСКИЙ – натуральный гормональный препарат, который необходим для регулирования работы половых желез у мужчин и женщин при нарушениях функций гипоталамуса и гипофизарно-гипоталамусной деятельности. Он широко применяется при адипозогенитальной дистрофии, болезни Симмондса, синдромах Шиена, гипофизарной карликовости с пониженными половыми проявлениями, пангипопитуитаризме (недостаточности гипофиза) всех разновидностей, гипогонадотропном гипогонадизме с явлениями евнухоидизма (заболеваниях мужских половых желез), бесплодии из-за дисфункции яичников, позднем половом развитии, при угрозе выкидыша на ранней стадии беременности, при дисфункциональных маточных кровотечениях у молодых женщин; при двустороннем крипторхизме (когда яички не опускаются в мошонку) у детей, а также при одностороннем крипторхизме после оперативного лечения при наличии признаков евнухоидизма. Во время применения препарата могут развиться следующие симптомы аллергических реакций: зуд, сыпь на кожных покровах, чрезмерное увеличение яичек, находящихся в паховом канале, и задержка их дальнейшего опусканию. При увеличении доз препарата у женщин в отдельных случаях возможна гиперстимуляция яичников с резким изменением их размеров. Препарат при воспалительных заболеваниях и опухолях половой сферы противопоказан. Заслуживает внимания тот факт, что длительное применение гонадотропина хорионического не рекомендуется, так как может подавляться гонадотропная функция гипофиза и происходить образование антител. ГОНАДОТРОПИН МЕНОПАУЗНЫЙ применяется при бесплодии у женщин со сниженной функцией яичников и ановуляторными циклами (скудные регулы, первичная или вторичная аменорея центрального генеза), при синдроме Шиена, а также у мужчин при бесплодии эндокринного генеза (гипогонадотропный гипогонадизм, евнухоидизм). Применение препарата возможно только под наблюдением лечащего врача, желательно в стационаре, так как при его передозировке возможны явления увеличения размеров яичников вследствие их мегастимуляции. В этом случае появляются боли в тазовой области, лабораторные анализы показывают увеличенную концентрацию гормонов в моче. ЛАКТИН – натуральный гормональный препарат, выделяемый из передней доли гипофиза животных (крупного и мелкого рогатого скота). Нормализует лактацию при недостаточном образовании молока в послеродовом периоде. Противопоказан в случае возникновения аллергических реакций различного рода. ДАНАЗОЛ применяют при гинекомастии и других подобных заболеваниях, доброкачественных новообразованиях молочной железы (фиброкистозном мастите и др.), эндометриозе с сопутствующим бесплодием, предменструальном синдроме, для лечения заболеваний, при которых показано подавление секреции гонадотропинов. Побочными эффектами лечения даназола могут быть облысение, головокружение, головная боль, задержка жидкости, кожная сыпь, появление угрей, сальность кожи, тошнота, огрубение голоса и другие изменения в работе голосовых связок. Даназол запрещен к применению во время беременности, кормления грудью, порфирии. При заболеваниях сахарным диабетом, сердечной и почечной недостаточностью его можно применять только под наблюдением лечащего врача. АДИУРЕКРИН – натуральный гормональный препарат задней доли гипофиза, применяющийся капельно при ночном недержании мочи и несахарном диабете (мочеизнурении). Побочным эффектом при приеме препарата может быть не только раздражение полости рта и слизистой носа, но и рост артериального давления, что является противопоказанием при гипертонической болезни. Препараты, восстанавливающие функцию щитовидной железы Каждый новый препарат для лечения заболеваний щитовидной железы, который выпускается во всем мире, проходит длительную апробацию, прежде чем выйдет в свободное применение. Поэтому мы отражаем только наиболее известные и проверенные препараты, поставляющие в организм необходимые вещества для восстановления работы щитовидной железы и иммунной системы. ТИРЕОИДИН, ТРИЙОДТИРОНИНА ГИДРОХЛОРИД, МЕРКАЗОЛИЛ. ТИРЕОИДИН – натуральный гормональный препарат, получаемый из щитовидных желез убойного скота. Лечение препаратом назначается в случае ожирения с явлениями гипотиреоза, первичного гипотиреоза и микседемы, эндемического и спорадического зоба, кретинизма, церебрально-гипофизарных заболеваний, протекающих с гипотиреозом, рака щитовидной железы. Тиреоидин снижает уровень холестерина в случаях заболевания атеросклерозом, однако препарат может провоцировать приступы стенокардии, поэтому его применение ограничено. Препарат должен применяться под контролем врача, поскольку в случае превышения его доз возможны симптомы токсического отравления (тиреотоксикоза) (потливость, учащение пульса, сердцебиение и др.), а также стенокардия, ухудшение протекания сахарного диабета и т. д. При уже проявившемся тиреотоксикозе, аддисоновой болезни, общем значительном истощении, сахарном диабете, тяжелых формах коронарной недостаточности применение препарата запрещено. Тиреоидин рекомендуется хранить в сухом, прохладном месте, в хорошо закупоренных банках темного стекла, а гранулы – в сухом месте при температуре не выше +25 °C. ТРИЙОДТИРОНИНА ГИДРОХЛОРИД аналогичен тиреоидину по применению, но он позволяет быстрее достичь результатов. Он быстрее всасывается, что особенно важно при лечении первой стадии гипотиреоза. Плюс этого препарата: он не вызывает аллергии, возможно его параллельное применение с тиреоидином. Рекомендуется очень осторожно применять трийодтиронина гидрохлорид для лечения гипотиреоза второй стадии в сочетании с недостаточностью коры надпочечников (побочное действие, возникающее на фоне этого, – обострение гипокортицизма (снижение уровня кортикоидов)). Остальные противопоказания аналогичны противопоказаниям вышеуказанного препарата. Препарат хранить в прохладном, защищенном от света месте. МЕРКАЗОЛИЛ является синтетическим гормональным препаратом, используется для лечения диффузного токсического зоба (легкой, средней и тяжелой форм). Побочным эффектом при его применении может стать развитие лейкопении; возможны зобогенный эффект, медикаментозный гипотиреоз, боли в суставах, тошнота, рвота, кожная сыпь, нарушения функции печени. При невозможности замены мерказолила другими препаратами снижают его дозу. В случае узловых формах зоба (исключение составляют тяжелые прогрессирующие заболевания, при которых временно исключена возможность операции), при лейкопении, а также в период лактации и беременности препарат противопоказан. Препарат хранить в прохладном, защищенном от света месте. ГОРМОНАЛЬНЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ОКОЛОЩИТОВИДНЫХ ЖЕЛЕЗ Для лечения расстройств деятельности паращитовидных желез применяются гормональные препараты, выделенные из аналогичных желез животных, оказывающие неоценимую помощь в борьбе с недугами. Но за годы разрушив гормональный баланс, мы, приобретя стойкое заболевание, хотим добиться быстрого исцеления и начинаем пачками глотать легкодоступные препараты. На память сразу же приходит изречение древних о том, что всякое вещество (простите за такую перефразировку) есть одновременно и лекарство, и яд. Разница между ними лишь в количестве дозы. Ответственность за разрушение нашего здоровья лежит, как правило, на нас же самих. Поэтому все препараты, предписанные врачом, необходимо принимать в строго назначенных дозах, тщательно следить за изменениями в состоянии организма, а при необходимости сразу же консультироваться со своим доктором. Наиболее известные гормональные препараты для лечения и профилактики перед вами. ПАРАТИРЕОИДИН ДЛЯ ИНЪЕКЦИЙ хранить в темном месте при температуре от +1 до +10 °C. ДИГИДРОТАХИСТЕРОЛ – в защищенном от света месте при температуре не выше +5 °C.  КАЛЬЦИТОНИН – хранение при температуре +2–8 °C, КАЛЬЦИТРИН – должен храниться при температуре не выше +2 °C в сухом, защищенном от света месте. Раствор препарата хранят при температуре +4 °C не более 5 дней. ПАРАТИРЕОИДИН Натуральный гормональный препарат, вырабатываемый из околощитовидных желез крупного рогатого скота. Применение его повышает содержание кальция в крови и устраняет нарушения, связанные с недостаточностью околощитовидных желез. При превышении доз паратиреоидина и соответственно повышенном содержании кальция наблюдаются общая слабость, вялость, диарея и рвота. Далее проявляются более четкие симптомы передозировки в виде резкой потери сил, ограничения движений вплоть до обездвиженности, отсутствия мышечного тонуса, состояния летаргического сна и в самых тяжелых случаях – коматозного состояния. В свете достижений фармакологии паратереоидин постепенно вытесняют более современные препараты. КАЛЬЦИТОНИН Обладающий гипокальциемическим действием гормональный препарат, получаемый как синтетическим путем, так и из щитовидной, вилочковой и паращитовидной желез млекопитающих. Кальцитонин назначают при системных заболеваниях, характеризующихся перестройкой скелета: спонтанном рассасывании костей, болезни Педжета, асептическом некрозе головок бедренных костей, несовершенном остеогенезе, стероидном, климактерическом, паратиреоидном и других видах остеопороза, фиброзной дисплазии, травматическом и лучевом остеомиелите, замедленном сращении переломов, зональной патологической перестройке костей у спортсменов, пародонтозе. Побочные эффекты от приема кальцитонина могут быть следующими: общая и местная гиперчувствительность (головокружение, тошнота, рвота, приливы крови к лицу). При возникновении данных реакций организма прием препарата прекращают. Противопоказания: препарат не подходит больным гипокальцимией, беременным и женщинам в период лактации. Также не исследовано его воздействие на детей. Очень осторожное рекомендуется применять лицам, страдающим хроническим ринитом. Интраназальное применение характеризуется повышенной биодоступностью. КАЛЬЦИТРИН – естественный гормональный препарат, получаемый из щитовидных желез животных. Вводится в организм в виде инъекций. Назначается он при замедленном сращении переломов, патологической зональной перестройке костей, остеопорозе, неэндокринных заболеваниях. Наблюдаются случаи аллергических реакций в зоне введения, повышения давления, приливов крови к лицу. Повышенная доза препарата в ряде случаев может вызвать тошноту и рвоту. В случае повышенной чувствительности к кальцитрину возможны парестезии, подергивания мышц (гипокальциемия). Полностью исключить препарат следует при беременности, кормлении грудью, гипокальциемии. Препараты женских половых гормонов и их синтетические аналоги Натуральные половые гормоны эстрогены играют большую роль в нормализации деятельности организма. Под их воздействием снижается уровень холестерина, восстанавливается нормальное количество алипопротеидов в крови. Почти все препараты, относящиеся к эстрогенной группе, назначают в случаях патологии функции яичников: гипоплазии полового аппарата и вторичных половых признаков, климактерических или посткастрационных расстройствах, слабости родовой деятельности, бесплодии, аменореях всех разновидностей, замедленном развитии половых органов. Противопоказания у них тоже практически едины: препараты запрещено принимать при злокачественных и доброкачественных новообразованиях половых органов, молочных желез и других органов у женщин (в возрасте до 60 лет), при склонности к маточным кровотечениям, мастопатии, эндометрите. Здесь же указан ряд препаратов, использующийся в гинекологической практике, синтетические производные гормонов, выделяемых мужскими половыми железами. Основное действие этих препаратов направлено на угнетение образования гипофизом гонадотропных гормонов и торможение процессов, происходящих в женской репродуктивной сфере. В данном случае эти препараты выступают в роли средств контрацепции. В настоящее время существует огромное количество оральных контрацептивов, многие из которых содержат в себе большое количество гормонов. Прием таких препаратов может привести к увеличению объемов и массы тела. Поэтому фармакологи пытаются усовершенствовать препараты, снижая в них содержание гормонов до минимума. Подбор гормонального препарата должен проводиться только врачом. л Перед назначением препарата женщине необходимо пройти осмотр, сдать анализы крови, мочи, измерить артериальное давление. Если назначение препарата проводится специалистом с учетом всех индивидуальных особенностей, то прием оральных контрацептивов не причинит никакого вреда. Использование препарата без рекомендаций врача может повлечь серьезный ущерб для здоровья. Гормональные контрацептивы предотвращают созревание фолликулов в яичниках и тормозят овуляцию, оказывают влияние на слизь в шейке матки, в результате чего она становится непроходимой для сперматозоидов, препятствуют прикреплению оплодотворенной яйцеклетки. Эффективность гормональных препаратов составляет практически 100 %, единственным условием является их регулярное применение. Существуют факторы, ослабляющие действие гормональных контрацептивов: курение, употребление большого количества алкоголя, рвота, некоторые лекарственные средства. Гормональные препараты помимо их основной направленности деятельности обладают противовоспалительным действием, снижают риск внематочной беременности, нормализуют менструальный цикл, предотвращают развитие онкологических заболеваний. Гормональные контрацептивы не влияют на детородную функцию, через некоторое время после их отмены у женщины восстанавливается способность к оплодотворению. Мы приводим список лекарственных средств, широко применяющихся в гинекологической практике. Описанию нескольких из них будет отведено место на страницах нашей книги. ЭСТРОН, ЭСТРАДИОЛА ДИПРОПИНАТ, ПРЕСОМЕН, ЭТИНИЛЭСТРАДИОЛ, СИНЕСТРОЛ, ДИЭТИЛСТИЛЬБЭСТРОЛ, ДИМЭСТРОЛ, СИГЕТИН, КЛОМИФЕНЦИТРАТ, ПРОГЕСТЕРОН, ОКСИПРОГЕСТЕРОНА КАПРОНАТ, ПРЕГНИН, НОРЭТИСТЕРОН, АЛЛИЛЭСТРЕНОЛ, АЦЕТОМЕПРОГЕНОЛ, БИСЕКУРИН, НОНОВЛОН, ОВИДОН, ЛИНДИОЛ, РИГЕВИДОН, МИНИСИСТОН, МАРВЕЛОН, АНТЕОВИН, ТРИЗИСТОН, ТРИРЕГОЛ, ТРИКВИЛАР, КОНТИНУИН, ПОСТИНОР, Таблетки «ПРЕГЭСТРОЛ», КЛИМОНОРМ, ДИВИНА и многие другие. ЭСТРОН – натуральный гормональный препарат, выделенный из мочи беременных женщин или беременных животных. Эстрон (фолликулин) по своим свойствам и воздействию аналогичен фолликулярному гормону эстрадиолу и входит в ряд эстрогенов или эстрогенных веществ, при введении которых в организм происходит стимуляция развития матки, вторичных женских половых признаков при их замедленном развитии, используется после хирургического вмешательства. С участием эстрона в организме женщины восстанавливаются функции половых желез в старшем возрасте, вызывается пролиферация эндометрия, так как гормон необходим женскому организму именно для нормального развития. л Вводится в организм инъекциями. В последнее время предпочтение отдается синтетическим эстрогенным аналогам, в лечении и профилактике используется этинилэстрадиол. Назначают эстрон при патологии, развившейся из-за дисфункции яичников, вторичной половой недостаточности, климактерических расстройствах, слабости родовой деятельности и переношенной беременности. Оказание помощи происходит и в случаях первичной и вторичной аменореи, гипертонической болезни в климактерическом периоде. Наблюдаются положительные изменения при спазме периферических сосудов. Но в случаях, когда препарат применяется долгий период, возможно появление маточных кровотечений, а назначенный для лечения и профилактики атеросклероза у мужчин вызывает феминизацию. Противопоказан эстрон при эндометрите, в гиперэстрогенной фазе климактерического периода, склонности к маточным кровотечениям, мастопатии; в случаях доброкачественных и злокачественных новообразований молочных, половых, других органов (после 60 лет это противопоказание снимается). СИНЭСТРОЛ относится к эстрогенным препаратам и используется в качестве сопутствующего средства при лечении онкологических заболеваний. Дает хороший эффект после хирургического вмешательства, лучевой терапии), легко переносится, но в ряде случаев наблюдается появление тошноты, рвоты, головокружения. Превышение доз препарата могут проявиться в понижении половой функции, уменьшения размеров яичек, пигментации сосков, набухании молочных желез у мужчин, токсическом повреждении печени, полиферация слизистой оболочки матки и кровотечения у женщин. Не рекомендуется применять синэстрол и аналогичные ему препараты во время беременности, при заболеваниях почек и печени. ПРОГЕСТЕРОН – натуральный гормон желтого тела, получаемый синтетическим путем в виде масляных растворов для подкожного и внутримышечного введения. Применяется для лечения бесплодия, недонашивании беременности, ановуляторных маточных кровотечениях, аменорее, альгодисменорее на почве гипогенитализма. Мужчинам назначают при лечении аденомы предстательной железы. В некоторых случаях при применении возникают побочные реакции: отечность, повышение артериального давления. Несколько противопоказаний приема препарата: склонность к тромбозам, онкологические заболевания молочной железы и половых органов, функциональные нарушения печени, гепатит. ПРЕГНИН – искусственный аналог гормона желтого тела, обладающий свойствами и действиями натурального гормона прогестерона. Эффективен при различного рода нарушениях функций яичников, дисфункциональных маточных кровотечениях, аменорее и ее разновидностях (гипоолигоменорее и альгоменорее), бесплодии (после курса введения других экстрогенных препаратов). При склонности к выкидышам препарат не назначается. БИСЕКУРИН – это комбинированный гормональный препарат, выполняющий не только контрацептивные функции, но применяемый и при генитальном эндометриозе, гипоплазии матки, дисменорее. В настоящее время существует огромное количество оральных контрацептивов, многие из которых содержат в себе большое количество гормонов. Одним из последних оральных контрацептивов, относящихся к данной группе, является жанин. ЖАНИН – один из последних оральных контрацептивов, относящихся к группе препаратов с пониженным содержанием гормонов. Как и другие контрацептивы, он предупреждает возникновения нежелательной беременности. Но даже несмотря на сравнительно малое содержание гормона этинилэстрадиола (всего 0,03 мг), он имеет побочные действия. Как правило, побочные эффекты от применения жанина возникают в первые несколько месяцев с начала его приема, но со временем они пропадают: боли и напряженность в области молочных желез, их заметное увеличение, кровянистые маточные выделения; головные боли, снижение или повышение полового влечение (половая гиперактивность), частые и резкие перепады настроения, нарушение зрения, нарушения со стороны желудочно-кишечного тракта, покраснения кожи, зуд. Редко – отечность, снижение или увеличение массы тела, возникновение аллергических реакций, повышенная утомляемость и развитие тромбозов. При этом применение жанина нежелательно при наличии у женщины следующих заболеваний и нарушений: артериальные и венозные тромбозы, постоянные мигрени, сахарный диабет различных форм тяжести, расстройство работы поджелудочной железы, в том числе панкреатит в стадии обострения, артериальная гипертензия, доброкачественная или злокачественная опухоль печени, печеночная недостаточность, обнаруженные злокачественные гормонозависимые заболевания, неопределенные вагинальные кровотечения, беременность и период лактации. При повышенной чувствительности к компонентам препарата необходима консультация гинеколога, который подберет аналогичный по действию контрацептив. ТРИЗИСТОН – контрацептивный гормональный препарат, действие которого, по мнению медиков, ничуть не отличается от естественных физиологических процессов. Кроме того, тризистон прекрасно переносится и подтверждает хорошую защиту. О противопоказаниях пока предпочитают не говорить. ИНФЕКУНДИН – женский половой гормон, получаемый искусственным путем. Назначают внутрь при дисфункциональных маточных кровотечениях (принимать по 1 таблетке каждые 4 ч.). Но при наличии опухоли нельзя принимать эстрогены, а также если имеются наклонности к тромбозам. ДИЭТИЛСТИЛЬБЭСТРОЛ – синтетический гормональный препарат, активней аналогичного ему соединения натуральных эстрона и синэстрола. В организм вводится в виде внутримышечных масляных инъекций. Применения данного препарата в настоящее время очень ограничено, так как имеет большое количество побочных реакций. В свете новых исследований и разработок появились более полные сведения о его воздействии на организм и найдены аналогичные по эффективности, но безопасные средства. Применение препарата ранее как эстрогенного, контрацептивного средства женщинами, по заявлению ученых, ведет у последних генетические изменения молекул ДНК. В дальнейшем у детей обоих полов, рожденных от таких женщин, происходят изменения в развитии половых репродуктивных органов, результатом которых может быть бесплодие. При онкологических заболеваниях молочной железы назначается пожилым женщинам, причем в минимальных дозах и под тщательным врачебным контролем. При болезнях почек и печени, тромбофлебите препарат противопоказан. ОВИДОН – противозачаточный препарат, тормозит овуляцию, предотвращает нежелательную беременность. Назначают при нарушениях менструального цикла, болях во время менструального цикла. Препарат может оказывать побочные действия: на пищеварительную систему, вызывая диспептические расстройства, на центральную нервную систему, провоцируя головные боли, сильную утомляемость. Овидон влияет на эндокринную систему, возникают колебания веса. Могут наблюдаться маточные кровотечения. Препарат имеет множество противопоказаниий, помимо общих, характерных для всех гормональных средств, противопоказан при гепатитах, холециститах, патологии сердца, анемиях. ТРИРЕГОЛ – гормональный контрацептивный препарат. Подавляет овуляцию. Показан при нарушениях менструального цикла. Препарат с осторожностью назначают женщинам, у которых имеется сахарный диабет, психические расстройства, патология со стороны сердечно-сосудистой системы, миома матки и мастопатия. Помимо основных побочных эффектов, характерных для препаратов данной группы, может провоцировать судорожный синдром. ТРИКВИЛАР – комбинированный контрацептивный препарат. Содержит гестаген и эстроген. Препятствует созреванию яйцеклетки, тормозит овуляцию. Не рекомендуется назначать курящим женщинам. Во время приема препарата необходимо осуществлять периодический контроль за уровнем артериального давления, содержанием холестерина в крови, проводить исследования молочных желез и функций печени. Побочные действия траквилара наблюдаются редко и только в самом начале применения. Траквилар противопоказан женщинам, подвергающим большим нагрузкам голосовые связки, т. е. профессиональным лекторам, дикторам, певцам. Препараты мужских половых гормонов и их синтетические аналоги Анаболики – это лекарственные препараты, которые стимулируют выработку белка в организме, а также способствуют удержанию белка в костных элементах. Они представлены кортикостероидами, аналогами мужских половых гормонов. Используются при заболеваниях, имеющих тенденцию к снижению веса, утрате аппетита, снижению защитных сил организма, которые возникли из-за больших потерь белка и развития дистрофии, а также при нарушение срастания костной ткани. Анаболики оказывают влияние на все процессы синтеза и распада белка в организме, через продукты которых осуществляется регуляция всех процессов жизнедеятельности. Поэтому не рекомендуется длительное применение анаболиков для наращивания мышечной массы, так как это может привести к серьезным последствиям для здоровья. У женщин применение анаболиков может приводить к повышенному оволосенению, изменению голоса, нарушениям менструального цикла. Открытие препаратов, имеющих свойства мужских половых гормонов – андрогенов – нашло широкое применение в различных областях медицинской практики, прежде всего в андрологии и гинекологии. В условиях стрессов и загрязненности окружающей среды происходят деструктивные изменения в гормональном фоне человека. Разбалансировка в первую очередь отражается на снижении функций половых гормонов, со значением которых вы ознакомились в главе «Гормональный фон и его изменения в течении жизни». Напомним, в свою очередь, что препараты данной группы имеют множественные побочные реакции, принимать их нужно в назначенных дозах и систематически наблюдаться у эндокринолога. Препараты данной группы отмечены в нашем списке. Аннотация некоторых из них представлены вашему вниманию: ТЕСТОСТЕРОНА ПРОПИНАТ, ТЕСТЭНАТ, РАСТВОР «ТЕТРАСТЕРОН», МЕТИТЕСТОСТЕРОН, Таблетки «ТЕСТОБРОМЛЕЦИТ», МЕСТЕРОЛОН. ТЕСТОСТЕРОНА ПРОПИОНАТ – препарат, получаемый синтетическим путем, имеет свойства своего натурального аналога, мужского полового (адрогенного) гормона тестостерона. Он, вырабатываемый в мужских гонадах, подталкивает молодой мужской организм к формированию половых органов и развитию вторичных половых признаков. Вырабатываться тестостерон начинает с момента полового созревания, а завершается в мужском климактерическом периоде, когда происходит постепенное угасание функций половых желез. Гормон влияет на фосфорный и азотистый обменные процессы. Нехватке тестостерона в случае кастрации или замедленного полового развития сопутствует нарушение образования белка, усиливается образование жировой ткани во внутренних органах и подкожной области, истощается скелетная мускулатура вплоть до атрофии. Эти изменения возможно приостановить с помощью препаратов тестостерона. У женщин тестостерон пропионат оказывает обратный эффект – замедляются функции гипофиза, участвующие в выработке женских половых гормонов, подавляются функции молочных желез, некоторым образом приостанавливается образование фолликул, частично атрофируется эндометрий. Эффективную помощь можно получить при остеопорозе, истощении, хронических инфекционных заболеваниях, тяжелых травмах и в постоперационный период. Положительный эффект достигается на начальной стадии гипертонии, в ряде форм стенокардии. Препарат служит для улучшения общего состояния, устранения расстройства мочеиспускания, при патологических изменениях предстательной железы, функциональных расстройствах половой системы, акромегалии, климактерическом синдроме у мужчин. Женщинам он помогает при опухолях молочных желез, половых органов, маточных кровотечениях и соответствующих этим заболеваниям нервных расстройствах, как правило, в сочетании с лучевой терапией женщинам до 60 лет, а в более позднем возрасте в случае дисфункциональных маточных кровотечениях. Тестостерона пропионат дает множественные побочные реакции, поэтому лечение и дозировка препарата должны проводиться под тщательным врачебным контролем, так как могут наблюдаться такие явления, как задержка воды и солей в организме, повышенное половое возбуждение, тошнота головокружение. Женщины, принимающие большие дозы препарата при дисменорее, рискуют «заработать» аменорею и вирильный синдром: это избыточный рост волос на лице и передней части брюшины, атрофия молочных желез, пастозность лица и огрубение голоса. Противопоказанием к применению препарата является онкологические заболевания предстательной железы. МЕТИЛТЕСТОСТЕРОН – синтетическое средство, аналогичное тестостерону, натуральному мужскому гормону, который отвечает за развитие мужских половых органов и вторичных половых признаков (как то оволосение лица и передней стенки брюшины, снижение тембра голоса, нарастание мышечной массы и пр.). Применение препарата оказывает эффект в случае нарушения половых функций в старшем возрасте или при замедлении полового развития в молодом организме. Как и большинство лекарств, относящихся к группе гормональных препаратов, метилтестостерон применяется под контролем лечащего врача. ТЕСТЭНАТ является андрогенным и анаболическим стероидным препаратом, применяющийся в случаях климактерических расстройств, раке половых органов, молочной железы при проведении лучевой терапии или оперативного вмешательства. РАСТВОР «ТЕСТОСТЕРОН» – андрогенный препарат, содержит эфиры тестостерона. Препарат оказывает влияние на развитие и функционирование мужских половых органов, а также на формирование вторичных половых признаков, конституции тела, участвует в регулирование полового поведения. Стимулирует синтез белка. Назначают при импотенции, мужском климаксе, остеопорозе, вызванным недостатком андрогенов. У женщин применяется при онкологических заболеваниях, климаксе, миоме матки. Вводят внутримышечно, лечение проводят курсами. Препарат может резко увеличивать половое влечение, вызывая частую эрекцию. В отдельных случаях наблюдается головокружение, тошнота, повышение уровня кальция в крови. У мальчиков тестостерон вызывает раннее половое развитие, преждевременное закрытие эпифизов костей. При выявленных нарушениях необходимо приостановить курс лечения. Противопоказан пожилым мужчинам. МЕСТЕРОЛОН – андрогенный препарат. Стимулирует развитие мужских половых органов, вторичных половых признаков, повышает потенцию. Препарат назначают при нарушениях потенции, снижении функций половых желез, мужском бесплодии. Побочным действием является слишком частая или продолжительная эрекция. Очень редко могут возникать патологические изменения в печени. Гормональные препараты, применяющиеся в онкопрактике Наряду с цитотоксическими противоопухолевыми препаратами в случаях некоторых онкологических заболеваний назначается ряд гормональных лекарственных средств, которые относятся к группе кортикостероидов (гормоны, вырабатываемые корой надпочечников), андрогенной группе (это производные мужских гонад), к примеру тестостерон и эстроген (эстрон – аналоги женских гормонов). Также применяются препараты, снижающие или подавляющие деятельность этих эндокринных желез в случаях, когда от опухоли являются гормонозависимыми. Эстроген необходим для торможения воздействия андрогена или, наоборот, для того, чтобы усилить деятельность эстрогенов, при онкологические заболевания мужских половых органов. Андрогены же назначаются, когда необходимо активизировать андрогенов или снизить воздействие эстрогенов в гинекологической онкопрактике. Применение прогестинов также показано при злокачественных новообразованиях в молочных железах и матке. Когда же появляется необходимость снижать секрецию глюкокортикостероидов, в ход вступают препараты, блокирующие функции надпочечников, как, например, в случае заболевания Иценко – Кушинга. При острых лейкозах и злокачественных лимфатических узлах в организм вводят глюкокортикостероиды из-за их способности угнетающе действовать на митоз лимфоцитов. Препараты этой группы обладают лимфолитическим действием. Важная роль гормональных препаратов в тормозящем, поддерживающем или исцеляющем лечении онкоболезней состоит в устранении нарушений регуляции функций здоровых клеток и торможении развития и деления опухолевых тканей на клеточном уровне. Концентрацию глобулина, который связывает андрогены и снижает содержание уровня тестостерона в организме, можно повысить с помощью эстрогенов. Им подвластно также снижение или блокирование опухолевого разрастания из-за того, что эстрогены угнетающе действуют на 5-Ааредуктазу (превращение тестостерона в дигидротестостерон, который подпитывает опухоль). Гормонам свойственно сочетаться с рецепторами, которые обнаруживаются как в нормальных тканях-мишенях, так и в опухолевых разрастаниях. Эффективность каждого препарата в практике гормонозависимых опухолей подтверждена многолетними наблюдениями, и назначаются они каждому больному с учетом диагноза, специфики заболевания, возраста, пола, особенностей организма. Ниже представлен список гормональных препаратов, благодаря специфическим свойствам которых наблюдается терапевтический и токсикологический эффект в лечении злокачественных опухолей. Характеристике некоторых из них мы уделили внимание. МЕДРОСТЕРОНА ПРОПИОНАТ, ПРОЛОТЕСТОН, ФОСФЭСТРОЛ, ХЛОРТРИАНИЗЕН, ПОЛИСТРАДИОЛ-ФОСФАТ, ЭСТРАЦИТ, ГЕСТО-НОРОНКАПРОАТ, МЕДРОКСИПРОГЕСТЕРОНА АЦЕТАТ, ТАМОКСИФЕН, ТОРЕМИФЕН, ФЛУТАМИД, ЦИПРОТЕРОНАЦЕТАТ, ХЛОДИТАН, АМИНОГЛЮТЕТИМИД МЕДРОТЕСТРОНА ПРОПИОНАТ – аналог тестостерона пропионата, в виде инъекций применяющийся при лечении запущенных гинекологических заболеваний, в пред– и послеоперационный период по причине рака молочной железы с метастазами, овариэктомии (удаления яичников, как одностороннего, так и двустороннего). При назначении препарата предпочтение отдается тем больным, у которых сохранен менструальный цикл, менопауза до 5 лет, дисфункция яичников. Так как медротестерона пропинат вызывает множественные побочные явления в виде гиперкальциурии (кальций в моче) и гиперкальциемии (опасного повышения уровня кальция в крови с дальнейшим подавлением центральной нервной системы, угнетением дыхательных и сосудодвигательных функций), паренхиматозного гепатита с желтухой в стадии обострения, нарушений сердечной деятельности, вирилизации (проявления у женщины мужских вторичных половых признаков в виде атрофии молочных желез, появления оволосения на теле, понижения тембра голоса, увеличения клитора). Противопоказанием для применения препарата являются гиперкальциемия острые заболевания печени и почек, сердечно-сосудистая система. ЭСТРАЦИТ – производное женского половодного гормона эстрогена, обладает гонадодотропными и цитотоксическими свойствами, не вызывает угнетения функций органов кроветворения. Применяется в случаях неэффективности лечения гормональными препаратами в онкологической практике, в частности при раке предстательной железы. В качестве побочных эффектов при введении в организм эстрацита могут быть аллергические реакции, боли в области сердца, диарея, гинекомастия, лейкопения, тошнота, рвота, тромбоэмболия. Острые заболевания сердца, печени и тромбофлебит у больного являются противопоказанием к приему препарата. МЕДРОКСИПРОГЕСТЕРОНА АЦЕТАТ – синтетическое средство, относящееся к прогестинам (гестагену). Применяется отдельно или совместно с другими препаратами гестагенной, антиэстрогенной, антиандрогенной и антиагонадотропной активности. В основном применяется как поддерживающее средство в случаях гормоночувствительных злокачественных опухолей. Во время наблюдения течения таких заболеваний, как рак молочной железы и рак матки (эндометрия), в тканях опухоли отмечено соотношение между эффективностью препарата и концентрацией уровня эстрогенов и прогестерона. Как противоопухолевое средство используется в качестве дополнения к другой группе препаратов в случаях рецидивов (повторных ухудшений), метастазов рака почки, эндометрия и гормонально-зависимого рака молочной железы в постменопаузе у женщин. ФЛУТАМИД, в основном используется для паллиативного лечения прогрессирующего рака предстательной железы (при цистостомии, трансуретральной резекции простаты). Одновременно необходимо форсированное насыщение организма фосфорилированными эстрогенами (фосфэстрол). Применяются синэстрол, эстрадуран, микрофоллин, хлортрианизен, флутамид чередующиеся друг за другом в виде ударных и поддерживающих курсов. В случае необходимости проведения дифференциальной диагностики гипогонадизма у мужчин им предварительно назначают флутамид для приема по определенной схеме. Противопоказанием для применения флутамида являются тяжелые заболевания щитовидной железы. печени, почек. Уменьшенные дозы препараты назначают при сопутствующих болезнях сердечно-сосудистой системы. Как следствие долговременного приема препарата могут возникать боли в грудных железах, гинекомастия (увеличение молочной железы у мужчин), может несколько подняться уровень метгемоглобина. При приеме препарата рекомендуется проводить исследования печени. ЦИПРОТЕРОНАЦЕТАТ относится к стероидным антиандрогенным гормональным веществам. Препарат обладает способностью тормозить в клетках-«мишенях» синтез дигидротестостерона и андрогеновых рецепторов, а также в опухолевых клетках предстательной железы. Ципротеронацетат снижает выработку половых гормонов, чем исключает их воздействие на опухолевые клетки. Нашел широкое применение в онкологической практике и назначается в случаях неоперабельных форм рака, в частности при раке предстательной железы. Эффект препарата может проявляться в случаях, когда опухоль резистентна к иным гормональным средствам. Так как ципротеронацетат обладает сниженной андрогенной активностью, что отрицательно сказывается на работе предстательной железы, на начальных стадиях онкологии простаты обычно назначают нестероидные андрогены. Длительный прием препарата у мужчин выявляет наличие гинекомастии и болевых ощущений в грудных железах, а женщины отмечают угнетение овуляции, снижение полового влечения. При передозировке препарата наблюдаются функциональные изменения печени, задержка жидкости в организме, отечность. Вещество используется для подавления повышенной активности андрогенов на запущенных стадиях в случаях тяжелого андрогенозависимого облысения или избыточного роста волос, зуда, шелушения волосистой части головы, угрей, преждевременного детского полового развития. Противопоказанием к назначению препарата является беременность. ХЛОДИТАН, выступает как ингибитор функции коры надпочечников и выполняет подавляющую роль секреции кортикостероидных веществ, в то же время вызывая глобальные изменения в тканях коры надпочечников. Препарат оказывает незаменимое воздействие в период постхирургического вмешательства по поводу удаления кортикостеромы, когда это еще целесообразно и при неоперабельных формах онкологии коры надпочечников (кортикостеромы) для подавления образования кортикостероидов и разрастания метастазов. В меньших дозах применение препарата эффективно в профилактике онкологических заюолеваний в постоперационный период, при отсутствии видимых метастазов, повышенной концентрации глюкокортикоидов, при болезни Иценко – Кушинга. Принимается он длительное время под контролем лечащего врача в сочетании с витаминотерапией. Побочным действием хлодитана являются головная боль, сонливость, понижение аппетита и тошнота. В зависимости от течения и тяжести заболевания назначается меньшая дозировка или полная отмена препарата. Противопоказаний к приему препарата в аннотации не отражено. АМИНОГЛЮТЕТИМИД, обладает свойствами торможения биосинтеза женских половых гормонов, выступает ингибитором соединений гидрокортизона и различных кортикостероидов, может выступать и как препарат, купирующий судорожный синдром. Основное применение – использованиеи при лечении женских онкологических заболеваниях. Назначается при опухолях коры надпочечников, раке молочной железы, болезни Иценко – Кушинга. Прием препарата назначают на длительное время, дозировка зависит от стадии заболевания. Побочным эффектом может выступить отек Квинке и аллергические реакции кожи. Инсулины, синтетические сахаропонижающие гормональные препараты МОНОИНСУЛИН хранить в защищенном от света месте при температуре от +4 до +1 °C. Замораживание не допускается. ХОМОРАППЕНФИЛ, особых рекомендаций по хранению нет. СУСПЕНЗИЯ ИНСУЛИНА СЕМИЛОНГ – сохранять в защищенном от света, прохладном (от +1 до +1 °C) месте. Замораживание не допускается. СУСПЕНЗИЯ ИНСУЛИНА ЛОНГ – в защищенном от света месте при температуре от +1 до +1 °C. СУСПЕНЗИЯ ИНСУЛИНА УЛЬТРАЛОНГ – в защищенном от света месте при температуре от +1 до +1 °C. БУТАМИД – в хорошо укупоренной таре в сухом месте. БУКАРБАН – в защищенном от света месте. ХЛОРПРОПАМИД – в хорошо укупоренной таре. ГЛИБЕНКЛАМИД – в защищенном от света месте. ГЛИПИЗИД, ГЛИКВИДОН, КЛИКЛАЗИД не имеют особых условий хранения. ГЛИБУТИД – в сухом месте. ГЛИФОРМИН – в защищенном от света месте. В качестве фитотерапевтического средства представлены: СБОР «АРФАЗЕТИН» (сохранять в сухом, защищенном от света месте. Настой сохраняют в прохладном месте не более 2 суток). СБОР «МИРФАЗИН» (хранение в сухом месте), о составе и действии которых будет сказано ниже, в разделе, посвященном фитотерапии. ИНСУЛИН Естественный гормон поджелудочной железы. Широко используется при заболевании диабетом (для понижения содержания сахара в крови) для подкожного или внутримышечного введения. Внутривенно его вводят по схеме при диабетической коме. Назначают для лечения при острой печеночной ж недостаточности при отравлениях, эклампсии на фоне нефрита (судорог, предкоматозного состояния), отравлениях этиловым спиртом, хинином. При остром гломерулонефрите, гемолитической желтухе, язвенной болезни желудка и двенадцатиперстной кишки, панкреатите, застойной сердечной недостаточности инсулин противопоказан. МОНОСУИНСУЛИН – естественный гормональный препарат, выделенный из свиного инсулина, для подкожного и внутримышечного введения. Имеет свойства, аналогичные препаратам инсулина. БУТАМИД – один из основных препаратов первого поколения, стимулирующих поджелудочную железу. Действие препарата – продолжительное по времени (от 5 до 12 ч.). Назначается внутрь перорально при сахарном диабете второго типа. Устраняет глюкозурию, нормализует уровень вещества в крови, чем дает возможность постепенно снизить дозу инсулина вплоть до отмены препарата. Применяется препарат под тщательным врачебным контролем, с систематическим исследованием мочи и крови на содержание глюкозы, соблюдением диеты. При его невысокой токсичности могут возникнуть негативные реакции организма в виде диспепсических явлений, головной боли, аллергических реакциях (зуд, дерматиты), тромбоцитопении, лейкопении, нарушений функции печени. Противопоказания у бутамида следующие: беременность и период лактации, детский и юношеский возраст, нарушения функции печени и почек, при острых инфекционных заболеваниях, легких формах диабета (компенсируемых одной диетой), кето-ацидоз, непосредственно при и после оперативных вмешательств, лейкопении, гранулоцитопении, аллергические реакции на применение сульфаниламидных препаратов, в прекоматозном и коматозном состоянии. ГЛИБЕНКЛАМИД является противодиабетическим препаратом, выступает как стимулятор бета-клеток поджелудочной железы. Как и все синтетические препараты, разработанные на основе естественных гормональных аналогов, обладает направленным воздействием, большей активностью (эффект наступает при значительно меньших дозах), быстрой всасываемостью, лучшей переносимостью. Кроме гипогликемического свойства, обладает ги-похолестеринемическим воздействием, что вызывает снижение свертываемости и тромбоза крови. Доза препарата подбирается с учетом возраста, веса, степени и течения заболевания, а при восстановлении нормального уровня содержания глюкозы предписывается ее уменьшение. Назначается к применению при сахарном диабете второго типа. Противопоказаниями являются такие заболевания и состояния, как детский и юношеский возраст, беременность и лактация, лейкопения, аллергические реакции на сульфаниламидные препараты, прекоматозное и коматозное состояние, кетоацидоз, нарушения функции печени и почек. Гормоны коры надпочечников и их синтетические аналоги Кора надпочечников млекопитающих и человека вырабатывает большое количество стероидных гормонов, которые называются кортикостероидами. Они являются производными прегнана и по химическому строению могут быть разделены на 11-дезоксистероиды, 11-оксистероиды и 11, 17-оксистероиды. К первой группе относится дезоксикортикостерон, не имеющий атома кислорода в положении 11 стероидного ядра. К группе 11, 17-оксистероидов относятся кортизол (гидрокортизон) и кортизон. Эти вещества выделены из коры надпочечников в кристаллическом виде. Для применения в качестве лекарственных средств кортикостероиды получают в настоящее время синтетическим путем. Целый ряд синтетических препаратов широко применяется в медицинской практике. Эндогенные гормоны коры надпочечников необходимы для жизни человека и животных. Животные погибают через несколько дней после удаления надпочечников (адренэктомии). Острая недостаточность надпочечников сопровождается сгущением крови, понижением артериального давления, желудочно-кишечными расстройствами, астенией, понижением температуры тела и основного обмена; наблюдаются также потеря натрия и задержка калия, гипогликемия, задержка в крови азотистых веществ. Введение адренэктомированным животным кортикостероидов (особенно при одновременном введении натрия хлорида и воды) приводит к исчезновению патологических явлений и сохранению жизни. По влиянию на обмен веществ основные кортикостероиды делятся условно на две группы: минералокортикостероиды и глюкокортикостероиды, или минералокортикоиды и глюкокортикоиды. Главными представителями первой группы являются альдостерон и дезоксикортикостерон. Эти гормоны активно влияют на обмен электролитов и воды и относительно мало – на углеводный и белковый обмен. Из препаратов, относящихся к группе минерало кортикостероидов, наиболее широкое применение в медицинской практике имеет дезоксикортикостерона ацетат (ДОКСА). Основными эндогенными (природными) глюкокортикостероидами являются кортизол (гидрокортизон) и кортизон. Они активно влияют на углеводный и белковый обмен, но менее активны в отношении водного и солевого обмена. Способствуют накоплению гликогена в печени, повышают содержание глюкозы в крови, вызывают увеличение выделения азота с мочой. Под влиянием глюкокортикостероидов изменяется картина красной и белой крови, развиваются эозинопения, лимфопения и нейтрофилия. Глюкокортикостероиды оказывают противовоспалительное, десенсибилизирующее и антиаллергическое действие. Они обладают также противошоковыми и антитоксическими свойствами. Характерным для глюкокортикостероидов является наличие у них иммунодепрессивной активности. В отличие от цитостатиков иммунодепрессивные свойства глюкокортикостероидов не связаны с митостати-ческим действием. Их иммунодепрессивный эффект является суммарным результатом подавления разных этапов иммуногенеза: миграции стволовых клеток (костного мозга), миграции В-клеток и взаимодействия Т– и В-лимфоцитов. По современным данным, кортикостероиды тормозят высвобождение цитокининов (интерлейкинов 1 и 2 и интерферона) из лимфоцитов и макрофагов, угнетают высвобождение эозинофилами медиаторов воспаления, снижают метаболизм арахидоновой кислоты (см. Простагландины). Стимулируя стероидные рецепторы, они индуцируют образование особого класса белков липокортинов, обладающих противоотечной активностью. В относительно больших дозах глюкокортикостероиды тормозят развитие лимфоидной и соединительной ткани, в том числе ретикулоэндотелия; уменьшают количество тучных клеток, являющихся местом образования гиалуроновой кислоты; подавляют активность гиалуронидазы и способствуют уменьшению проницаемости капилляров. Под влиянием глюкокортикостероидов задерживается синтез и ускоряется распад белков. Выработка гормонов надпочечника находится под контролем ЦНС и в тесной связи с функцией гипофиза. Адренокортикотропный гормон гипофиза (см. АКТГ, кортикотропин) является физиологичесним стимулятором коры надпочечников; без него невозможна нормальная функция коры надпочечников. При различных неблагоприятных воздействиях, вызывающих в организме состояние напряжения (стресса), происходит усиление функций гипофиза, сопровождающееся выделением увеличенного количества кортикотропина и стимулированием функции коры надпочечников. Кортикотропин усиливает преимущественно образование и выделение глюкокортикостероидов. Последние, в свою очередь, влияют на гипофиз, угнетая выработку кортикотропина и уменьшая таким образом дальнейшее возбуждение надпочечников. Длительное введение в организм глюкокортикостероидов (кортизона и его аналогов) может привести к угнетению и атрофии коры надпочечников, а также к угнетению образования гонадотропных и тиреотропного гормонов гипофиза. Из природных глюкокортикостероидов практическое применение в качестве лекарственных средств нашли получаемые синтетическим путем кортизон, гидрокортизон и дезоксикортикостерон. Получен целый ряд синтетических аналогов кортизона и гидрокортизона (преднизон, преднизолон, дексаметазон и др.), нашедших широкое применение. Эти соединения активнее, чем природные глюкокортикостероиды, действуют в меньших дозах, слабее влияют на минеральный обмен; некоторые из них (главным образом фторированные производные) более удобны для местного применения, так как меньше всасываются. Синтетические аналоги в настоящее время почти полностью заменили кортизон. Основными показаниями к применению глюкокортикостероидов являются коллагенозы, ревматизм, ревматоидный артрит (инфекционный неспецифический полиартрит), бронхиальная астма, острый лимфобластный и миелобластный лейкоз, инфекционный мононуклеоз, нейродермиты, экзема и другие кожные заболевания, различные аллергические заболевания. Применяют также глюкокортикостероиды при болезни Аддисона, острой гормональной недостаточности коры надпочечников, гемолитической анемии, гломерулонефрите, остром панкреатите, вирусном гепатите и других заболеваниях. В связи с противошоковым эффектом глюкокортикостероиды назначают для профилактики и лечения шока (посттравматического, операционного, токсического, анафилактического, ожогового, кардиогенного и др.). Иммунодепрессивное действие глюкокортикостероидов позволяет использовать их при трансплантации органов и тканей для подавления реакции отторжения, а также при различных так называемых аутоиммунных заболеваниях. Глюкокортикостероиды являются во многих случаях весьма ценными терапевтическими средствами. Необходимо, однако, учитывать, что они могут вызывать ряд побочных эффектов, в том числе симптомо-комплекс Иценко – Кушинга (задержку натрия и воды в организме с возможным появлением отеков, усиление выведения калия, повышение артериального давления); гипергликемию вплоть до сахарного диабета (стероидный диабет); усиление выделения кальция и остеопороз; замедление процессов регенерации; обострение язвенной болезни желудка и двенадцатиперстной кишки, изъязвления пищеварительного тракта, прободение нераспознанной язвы, геморрагический панкреатит, понижение сопротивляемости к инфекциям; повышение свертываемости крови с возможностью тромбообразования; появление угрей, лунообразного лица, ожирения, нарушений менструального цикла и др. Возможны также нервные и психические нарушения: бессонница, возбуждение (с развитием в некоторых случаях психозов), эпилептиформные судороги, эйфория. Некоторые побочные явления (особенно связанные с задержкой натрия и воды в организме) менее выражены при применении синтетических глюкокортикостероидов (триамцинолона, дексаметазона и др.) вследствие их меньшего минералокортикоидного действия. При длительном применении глюкокортикостероидов следует учитывать возможность угнетения функции коры надпочечников с подавлением биосинтеза гормонов; не исключена атрофия надпочечников. Введение кортикотропина одновременно с глюкокортикостероидами предотвращает атрофию надпочечников. Внезапное прекращение введения глюкокортикостероидов может вызвать обострение процесса. Окончание лечения должно производиться путем постепенного уменьшения дозы. В течение 3–4 дней после отмены препарата назначают небольшие дозы кортикотропина (10–20 ЕД в сутки) для стимулирования функции коры надпочечников. Частота и сила побочных явлений, вызываемых глюкокортикостероидами, могут быть выражены в разной степени. При правильном выборе дозы, соблюдении необходимой предосторожности, тщательном наблюдении за ходом лечения побочные явления могут отсутствовать. В связи с возможным побочным действием применение глюкокортикостероидов должно производиться только при наличии четких показаний и под тщательным врачебным контролем. Для уменьшения побочных явлений во время лечения глюкокортикостероидами следует вводить в организм достаточное количество полноценного белка, уменьшить введение хлоридов и увеличить долю калия (1,5–2 г в сутки). Необходимо постоянно следить за уровнем АД, содержанием глюкозы в крови, свертываемостью крови, диурезом и массой тела больного. Противопоказания к применению глюкокортикостероидов совпадают в основном с противопоказаниями к применению кортикотропина. Препараты, содержащие глюкокортикостероиды (мази, капли), не должны применяться при вирусных заболеваниях глаз и кожи (в том числе препараты с добавлением антибактериальных средств), так как в связи с угнетением процессов регенерации возможно образование распространенных язв вплоть до прободения роговицы. Не следует применять мази, содержащие кортикостероиды, при грибковых и паразитарных поражениях кожи, если к этим мазям не добавлены специальные противогрибковые или противопаразитарные средства (см. Микозолон). Все препараты глюкокортикостероидов сохраняют с предосторожностью (список Б), в защищенном от света месте. КОРТИЗОН ГИДРОКОРТИЗОН ГИДРОКОРТИЗОНА АЦЕТАТ ГИДРОКОРТИЗОНА ГЕМИСУКЦИНАТ ПРЕДНИЗОЛОН ПРЕДНИЗОЛОНГЕМИСУКЦИНАТ МЕТИПРЕДНИЗОЛОН ДЕКСАМЕТАЗОН ТРИАМЦИНОЛОН ТРИАМЦИНОЛОНА АЦЕТОНИД СИНАФЛАН ФЛУМЕТАЗОНА ПИВАЛАТ ГАЛОМЕТАЗОН БЕТАМЕТАЗОН БЕКЛОМЕТАЗОНА ДИПРОПИОНАТ ДЕПЕРЗОЛОН ДЕЗОКСИКОРТИКОСТЕРОНА АЦЕТАТ ДЕЗОКОРТИКОСТЕРОНА ТРИМЕТИЛАЦЕТАТ ФТОРГИДРОКАРТИЗОНА АЦЕТАТ Основные характеристики некоторых из них. АДРЕНАЛИН в качестве лекарственного вещества производят синтетическим путем или вырабатывают из тканей надпочечников животных. Изучению адреналина как лекарственного препарата было посвящено много времени и с подробным описанием его воздействия на организм человека можно ознакомиться, прочитав справочник лекарственных средств. Мы же кратко упомянем о его применении в случаях отдельных заболеваний. Это эффективное средство при аллергическом отеке гортани, аллергических реакциях на препараты пенициллинового ряда, сыворотки и другие аллергены, при гипергликемической коме (при передозировке инсулина), бронхиальной астме (для купирования острых приступов, снятия бронхиолоспазма). Оказывает эффективную кардиостимуляцию и дает положительный результат при резком снижении возбудимости миокарда (применение очень ограничено из-за побочных эффектов). Используется в сочетании с другими местно анестезирующими веществами в виде инъекций как сосудосуживающее (для уменьшения кровотечений) и противовоспалительное средство (в отдельных отоларингологических и офтальмологических случаях), как один из компонентов мазей и капель. Благодаря адреналину происходит расслабление мышц бронхов и кишечника, снимается утомление функциональной работы мышц скелета, повышается содержание в крови и улучшается тканевый обмен. Но применение этого препарата дает очень много побочных эффектов. Из них можно выделить такие, как тахикардия, повышение артериального давления; могут появиться боли в области сердца, экстрасистолии, аритмии, тремор, беспокойство, головные боли, усиливается ригидность мышц. Препарат противопоказан к применению при закрытоугольной (узкоугольной) глаукоме, беременности, аневризмах, гипертензии, выраженном атеросклерозе, тиреотоксикозе, сахарном диабете. Нельзя применять адреналин при наркозе фторотаном, циклопропаном (в связи с появлением аритмий). КОРТИЗОН – натуральный стероидный гормон, имеет ограниченное применение в связи с большим спектром побочных реакций. В настоящее время на основе кортизона разработаны синтетические глюкокортикоидные препараты, более эффективные и легко переносимые. Препарат назначается только после глубокого обследования, кроме того, необходимо обеспечить постоянное наблюдение врача за массой тела, картиной крови, содержанием глюкозы в крови, артериальным давлением, состоянием психики, что возможно, как правило, только в условиях стационара. Последствия длительного лечения и больших доз кортизона могут быть следующими: вирильное ожирение, гирсутизм, нарушения менструального цикла, остеопороз, симптомокомплекс Иценко – Кушинга, психические нарушения, угри, возможны прободения нераспознанной язвы, изъязвления пищеварительного тракта, геморрагический панкреатит. ГИДРОКОРТИЗОН является производным кортизона, используется в лечении таких заболеваний, как бурсит, артрит, тендовагинит, воспалительных и аллергических заболеваний кожи немикробной этиологии (аллергическом и контактном дерматите, экземе, нейродермите). Применяется под контролем лечащего врача с систематическим обследованием крови, артериального давления, состояния психики и массы тела. Побочные явления при применении препарата случаются довольно часто. Такие явления, как вирильное ожирение, гирсутизм, угри, нарушения менструального цикла, остеопороз, симптомокомплекс Иценко – Кушинга, психические нарушения, геморрагический панкреатит, изъязвления пищеварительного тракта, прободения нераспознанной язвы, являются основанием для исключения из применения препаратов гормональной принадлежности. В случае инфекционных заболеваний кожи, при язвенных поражениях кожи, туберкулезе, микозах, пиодермии, ранах применение гидрокортизона противопоказано. В последнее время препарат не так широко используется, так как существуют более эффективные синтетические аналоги. ПРЕДНИЗОЛОН выступает в роли аналога гидрокортизона. Является незаменимым средством при бронхиальной астме, инфекционном полиартрите, ревматизме, лимфатической и миелоидной лейкемии в стадии обострения, инфекционном мононуклеозе, нейродермитах. Неплохой эффект достигается при миастении, хроническом гломерулонефрите и циррозе печени. В случае крайней необходимости преднизолон используется при астматических состояниях, приступах бронхиальной астмы, шоке, острой недостаточности надпочечников. МЕТИЛПРЕДНИЗОЛОН относится к группе глюкокортикостероидов и является синтетическим аналогом преднизолона, но по сравнению с ним лучше переносится организмом, не задерживает натрий в организме и оказывает более эффективное действие. Широко применяется как в виде инъекций, так и в таблетированной форме. Внутримышечное введение препарата дает эффект на более продолжительный срок, в связи с чем метилпреднизалону отдается большее предпочтение перед гидрокортизоном и преднизолоном. Показания к применению: бронхиальная астма, тяжелые формы волчаночного нефрита, хронические полиартриты, ревматизм, дискогенный радикулит. Препарат вводится в полость сустава 1 раз в 1–5 недель. Для снятия болевых симптомов достаточно иногда разовой дозы препарата. О противопоказаниях и осложнениях в результате приема препарата указано выше в описании группы гормональных препаратов. ДЕЗОКСИКОРТИКОСТЕРОНА АЦЕТАТ (ДОК-СА), получаемый искусственно, по своим свойствам он не уступает естественному гормону коры надпочечников. Относится к минералокортикостероидам и служит для повышения тонуса и улучшения работоспособности мышечных волокон. Применяется ДОКСА при астении, адинамии, миастении, общей мышечной слабости, гипохлоремии, болезни Аддисона и гипокортицизме (временном понижении функции коры надпочечников). При использовании препарата необходим тщательный врачебный контроль, так как побочными эффектами при его применении и превышении дозы являются задержка натрия и воды в организме, отечность, повышение артериального давления со всеми присущими ему симптомами. При таких заболеваниях, как атеросклероз, гипертоническая болезнь, стенокардия, сердечная недостаточность с отеками, цирроз печени, нефрит, нефроз, применение препарата невозможно. ДЕЗОКСИКОРТИКОСТЕРОНА ТРИМЕТИЛАЦЕТАТ Применяется при астенических состояниях с гипертензией после инфекционных заболеваний, болезни Аддисона, гипотоническом синдроме, недостаточности коры надпочечников, диэнцефально-гипофизарной недостаточности и др. Применяется в совокупности с глюкокортикостероидами. Лечение необходимо проводить только под наблюдением лечащего врача со строгим соблюдением дозировки препарата, так как передозировка может вызвать повышение артериального давления и отеки (вследствие задержки натрия и воды). Кроме того, во время приема лекарства жизненно необходимо соблюдать сбалансированную диету. Гипертоническая болезнь, заболевания почек с различного рода функциональными нарушениями, сердечная недостаточность с застойными явлениями и цирроз печени являются противопоказаниями к приему препарата. ПРОПРАНОЛОЛ – синтетическое вещество, аналог стрессовых гормонов, вступающий в соединение с рецепторами на поверхности живых клеток. Разработка американских ученых-медиков. Принцип действия препарата заключается в том, что в условиях стресса человек не теряет ощущения спокойствия, не сохраняет негативных эмоций, но до мельчайших подробностей помнит все, что происходило вокруг него в момент стрессовой ситуации. Этим средством активно интересуются военные структуры. Народная медицина предлагает большой выбор трав и методов лечения. Итак, из всего вышеперечисленного видно, к каким последствиям может привести применение гормональных препаратов в лечении заболеваний. Их дозы и прием должны контролироваться врачами, но, к сожалению, даже им иногда свойственно делать ошибки. К сожалению (или к счастью), гормональные препараты подходят далеко не всем: противопоказаний при приеме очень много, а еще больше осложнений, провоцируемых лекарствами. Фитогормоны и их применение для нормализации уровня гормонов У приема гормональных препаратов существует альтернатива – применение фитопрепаратов и сборов. Приведение организма в состояние равновесия с помощью других средств в последнее время получает все большую популярность. Народная (нетрадиционная) медицина предлагает большой выбор трав и методов лечения. Как читатель уже, наверное, понял, последствия лечения гормонами могут сказаться пагубно не только на организме, но и на жизни человека (чего только стоит развитие заболеваний, изменяющих его внешний облик). Но это можно предотвратить, если не тянуть с лечением до последнего момента, когда уже ничего, кроме операции, помочь не сможет. Далее попытаемся рассказать о гормонозаменителях, широко использующихся как в народной, так и в профессиональной медицине в последнее время. О том, что такое фитогормоны, уже сказано. Первое место в нашем списке фитогормонов решили отдать русской красавице – березе. Приготовленные из нее лечебные средства значительно облегчают протекание в организме человека метаболических и гормональных процессов, а также начало климактерического периода у лиц обоего пола. Целебные свойства березы были замечены еще во времена царской России. Приведем рецепт настоя, который был предложен земским врачом Антоном Аренским. Для его приготовления нужно собрать молодые листочки и почки березы, посушить их 1–2 дня под яркими солнечными лучами. После полного высушивания 1 часть смеси залить 4 частями спирта, плотно закрыть и настаивать 2 месяца в ярком солнечном месте. Готовый настой процедить через фланель. Курс приема был неограничен, а вот способ применения следующий: 1–2 ч. л. настоя разводится в стакана воды и принимается примерно за полчаса до еды (перед каждым приемом пищи, т. е. 2–3 раза в день). Помимо нормализации уровня гормонов, этот настой очень помогает женщинам нормализовать кровотечения в период климакса.  Бузина также является естественным фитогормоном. Наиболее полезными в ней считаются ягоды, цветы, высушенные листья и корни. Бузина аналогична половым гормонам человека, неспроста в древние времена ее использовали для лечения аденомы, фибромиомы и т. д. Бузину тоже можно употреблять в любом виде: из нее готовят настои, отвары, напитки, десерты (джем, желе, мармелад, мусс, повидло) и даже лечебные ванны. Фитогормоны, попадая в наш организм, нормализуют деятельность желез внутренней секреции, сводя к минимуму прием лекарственных препаратов, полученных в лабораториях. Недаром раньше говорили, что лучшие лекарства дает сама природа. Фитогормоны, содержащиеся в липе, по своему действию похожи на женские половые гормоны. Липа обладает потрясающим омолаживающим действием, из нее готовят отвары и чаи. Последний, кстати, нормализует менструальный цикл. В предклимактерический период (после 40 лет) женщинам рекомендуется два раза в год в течение месяца пить по утрам липовый чай (на 1 стакан кипятка достаточно 1 ч. л. сухих цветов) – он облегчает перестройку организма и подготавливает его, таким образом, к климаксу. Истинной сокровищницей фитогормонов с давних времен считается шалфей. Он также аналогичен женским половым гормонам и обладает омолаживающим эффектом. Ближе к 40 годам женщины, желающие «цвести» дольше, должны через каждые 4 месяца в течение 3–4 недель пить по утрам за 30–40 минут до еды настой из шалфея (1 ч. л. сушеной травы заливается 1 стаканом кипятка и настаивается до остывания, для улучшения вкуса можно добавлять мед или лимон). Для тех, кто хочет зачать здорового ребенка, не обязателен прием искусственных гормонов, семена шалфея полезны и здесь. Из них готовится настой: 1 ч. л. семян шалфея заливается 1 стаканом кипятка и настаивается до остывания. Курс приема – по 11 дней в течение 3 месяцев (сразу же после прекращения менструаций). Принимают настой 2 раза в день, утром – обязательно натощак и перед сном, по 1 ст. л. Если беременность не наступает, то лечение повторяется после двухмесячного перерыва. Липа и шалфей считаются очень сильными гормонами растительного происхождения, особенно если их сочетать вместе. Только стоит помнить о том, что шалфей может спровоцировать пищевую аллергию или сильное отравление. Так что, как и с лекарственными средствами, необходимо соблюдать определенные дозы, подобранные индивидуально. Также есть множество трав, которые применяются тогда, когда лекарственные препараты, предложенные традиционной медициной, не подходят человеку. При этом данные травы фитогормонами не являются, но содержат не менее эффективные вещества. Из таких трав составляют сборы, также в аптеке можно приобрести отдельные травы. Для лечения кисты можно применять следующий сбор, все компоненты которого берутся в равном количестве (примерно по 1 ст. л.). Травы полыни горькой, тимьяна, перечной мяты, володушки, черноголовки, яснотки, плоды боярышника, листья крапивы и смородины тщательно перемешиваются. Затем в 1 л кипятка добавляют 2 ст. л. смеси и настаивают в течение 3–4 ч. Курс приема – 3 месяца, по 1 стакану в день до или после еды. Вторая рецептура тоже отличается сложным составом. Для приготовления отвара измельчаются в равных долях сушеные листья крапивы, корень девясила и левзеи, травы пастушьей сумки, горькой полыни, тысячелистника, череды и цветки лекарственной ромашки. Затем 2 ст. л. смеси заливаются 1 л холодной кипяченой воды. Все это кипятится на медленном огне в течение 15–20 мин. Когда отвар остынет, его нужно процедить через марлю. В течение дня рекомендуется выпивать по 1,5–2 стакана отвара. Гормонозаместительная терапия порой может дать наилучший результат! Очень часто врачи прописывают фитотерапию во время реабилитационного периода. Правильно подобранные травы нормализуют не только работу эндокринной системы, но и всего организма в целом. Приведем несколько рецептов настоев, наиболее часто используемых после гинекологических операций. Самый простой целебный настой состоит из трав, которые можно заготавливать впрок в экологически чистых районах нашей страны. Берется одинаковое количество цветков лекарственной ромашки, семян укропа, травы зверобоя и тысячелистника, брусничных листьев, чабреца, цветков арники и травы пастушьей сумки. Все это тщательно смешивается и заливается кипятком (из расчета 1 ст. л. сбора на 1 л воды). Настаивается в течение 45 мин. до остывания. Курс приема неограничен, а вот доза – по 1 ст. л. до еды 2 раза в день. Следующий состав отличается неодинаковостью количества необходимых трав и растений. Потребуется по 1 ст. л. сушеной крапивы и корней родиолы; по 2 ст. л. цветков лекарственной ромашки, листьев манжетки, травы пустырника, володушеи и пастушьей сумки, коры калины; ягоды рябины – 3 ст. л. После смешивания берется 1 ст. л. смеси, заливается 1,5 стаканами холодной кипяченой воды и на протяжении 15–20 мин. нагревается на водяной бане. Рекомендуется принимать настой по 1/3 стакана в день за полчаса до еды. Наряду с такими «полными составами» есть и куда более простые и легкие. Для приготовления такого средства требуется 1 ст. л. листьев розмарина и 1 стакан крутого кипятка. Все это смешивается, настаивается до остужения и процеживается. Способ применения – по 1 ст. л. 3 раза в день за полчаса до еды. Среди фитотерапевтических рецептов есть и средства, помогающие при лечении бесплодия. Применение народных способов в сочетании с лекарственными негормональными препаратами дает наилучший эффект. Приведем ниже некоторые рецепты. В состав смеси входят по 1 ст. л. корней и листьев петрушки, цветов и листьев лесного просвирника, листьев лекарственной мелиссы. Измельченная и тщательно перемешанная смесь заливается 3 стаканами холодной воды. В смесь добавляется 1/2 ст. л. аниса, все варится 10 мин. на слабом огне. Курс приема зависит от курса приема лекарственных препаратов, а вот доза – 1/2 стакана отвара в день. Принимать строго после приема пищи. В основном все отвары и настои принимаются примерно за полчаса до еды. Объясняется это тем, что, попадая в наш организм, они сначала должны сами распределиться и усвоиться организмом, чтобы потом легче протекало усвоение принимаемой пищи. Способ приготовления практически у всех сборов аналогичный, поэтому только перечислим составы некоторых из них. Помимо этих народных способов заместительной терапии, есть сборы, одобренные традиционной медициной. В последнее время врачи все чаще и чаще стараются назначать более натуральные лекарственные средства. К одним из официально признанных относятся сборы «Арфазетин» и «Мирфазин». Сбор «Арфазетин»Состав: побеги черники – 20 %, створки плодов фасоли обыкновенной – 20 %, корень аралии маньчжурской или корневища с корнями заманихи 15 %, плоды шиповника – 15 %, трава хвоща полевого, трава зверобоя и цветки ромашки аптечной – по 10 %. Настой сбора оказывает гипогликемическое действие и используется при лечении сахарного диабета легкой и средней тяжести как самостоятельно, так и в сочетании с производными сульфанилмочевины и препаратами инсулина. При клиническом применении отмечено, что у больных сахарным диабетом I типа заметного гипогликемического эффекта не наблюдалось, вместе с тем обнаружены хорошие результаты у больных диабетом II типа, что позволяет в некоторых случаях уменьшать суточную дозу пероральных антидиабетических препаратов. Для приготовления настоя содержимое одного пакета «Арфазетина» (10 г) помещается в эмалированную посуду, заливается 400 мл (2 стакана) горячей кипяченой воды, нагревается в кипящей воде (на водяной бане) в течение 15 мин., охлаждается при комнатной температуре в течение не менее чем 45 мин., процеживается. Оставшееся сырье отжимается. Полученный настой доливается кипяченой водой до первоначального объема (400 мл). Настой необходимо принимать за 30 мин. до еды, лучше в теплом виде, по 1/3 – 1/2 стакана 2–3 раза в день в течение 20–30 дней. Через 10–15 дней курс лечения рекомендуется повторить. В течение года проводят 3–4 курса. При применении настоя в сочетании с антидиабетическими препаратами необходимо соблюдать правила приема, меры предосторожности и учитывать противопоказания, предусмотренные для этих препаратов. Формы выпуска: по 10 г в полиэтиленовых пакетах в упаковке по 10 пакетов, а также в виде круглых брикетов массой 8 г, используемых для приготовления настоя, выпускаемых в упаковке из поливинилхлоридной пленки по 6 штук. Хранение сбора и брикетов: в сухом, защищенном от света месте. Настой сохраняют в прохладном месте не более 2 суток. Сбор «Мирфазин»Сбор «Мирфазин», подобно сбору «Арфазетин», применяется в качестве дополнительного гипогликемического средства при лечении легких форм сахарного диабета. Сбор используют как самостоятельно, так и в комбинации с пероральными антидиабетическими препаратами (производными сульфанилмочевины). В отличие от сбора «Арфазетин» сбор «Мирфазин» состоит не из 7, а из 12 лекарственных растений: по 14,3 % побегов черники обыкновенной и створок плодов фасоли обыкновенной, по 7,14 % плодов шиповника, листьев крапивы, подорожника большого, цветков ромашки, календулы, травы зверобоя, тысячелистника, пустырника, корня солодки, корневищ и корней девясила. Удельное значение каждого из этих растений недостаточно изучено. Применяется внутрь в виде настоя: 5 г (1 ст. л.) сбора заливается 200 мл кипяченой воды, нагревается в течение 15 мин. на водяной бане, 15 мин. настаивается, затем процеживается, остаток отжимается. Принимают в теплом виде за 20–30 мин. до еды из расчета 1 мл на 1 кг массы тела 3 раза в день. Курс лечения продолжается 4–6 недель, в течение года повторяют 3–4 курса. Форма выпуска: измельченное сырье в бумажных пакетах по 75 г. Хранение: в сухом месте. На самом деле здесь описаны далеко не все рецепты приготовления антигормональных препаратов. Но их описание может занять еще не одну страницу и станет лишним. Поэтому стоит перейти к другим способам, предотвращения гормональной катастрофы. Помимо всего прочего, чтобы не превышать дозу препарата, если уж его применение так необходимо, надо тщательно соблюдать все предписания врача и в случае возникновения дискомфорта или побочных действий незамедлительно ему об этом сообщать. Нельзя заниматься самолечением гормональными препаратами. Ведь даже эндокринолог может назначить сильнодействующее лекарство только после тщательного обследования. Обнаружив у себя первые симптомы гормонального нарушения, необходимо сразу же идти в поликлинику, да и обычный профилактический осмотр примерно раз в полгода не помешает. Чтобы не стать «заложником» своих же собственных гормонов, старайтесь как можно больше двигаться. Человек не должен зависеть от работы организма! Об этом уже было написано во второй главе нашей книги, но будет нелишне повторить, что «движение – это жизнь». И не стоит об этом забывать. Снизив однажды свою двигательную активность, мы тем самым сокращаем выработку соматотропного гормона. Естественным путем его недостаток очень сложно восполнить, а лекарственные препараты не всегда оказывают помощь, напротив, эффект может стать обратным! То же самое можно сказать и о других гормонах, содержание которых либо слишком низкое, либо слишком высокое. Зная, что каждый гормон отвечает за определенную функцию, человек примерно может определить для себя, что надо делать, а что не надо. Но это совершенно не означает, что о посещении эндокринолога можно забыть! Просто предупреждая заранее развитие нарушений, мы упрощаем жизнь и себе, и доктору. Кстати, в настоящее время большую популярность приобретают физические упражнения при бесплодии: разрабатываются гимнастические курсы, лечебная физкультура. Конечно, одними занятиями данную проблему не решить, но консультация врача, который назначит необходимые комплексные методики, включающие и упражнения, и применение лекарственной терапии, может принести долгожданные результаты. Упражнения направлены на общее укрепление организма, также они предохраняют от возникновения осложнений, что играет немаловажную роль для тех, кто уже отчаялся испытать радость материнства и отцовства. Не последнюю роль играет психотерапия. И с этим нельзя не согласиться. Во второй главе книги нами уже указывалось, что зачастую причиной заболеваний являются наши собственные мысли и эмоции («все болезни от нервов...»). Но если человек так хочет быть здоровым, то почему бы не отказаться от излишних проявлений чувств и, как следствие, разрушения нервных клеток. Надо относиться к жизни спокойней, тогда и гормоны будут в норме, и самочувствие улучшится. Психотерапевты часто говорят своим пациентам, что нужно постоянно убеждать себя в том, что «я здоров!». И еще. Важно уметь как можно чаще находить в жизни положительные моменты и искренне радоваться им (а пока вы радуетесь, ваш организм с удовольствием выделяет гормон эндорфин!). Ведь счастье продлевает жизнь. Может, оно и гормональные нарушения сведет на нет? У гормонов есть свои особенности, и не важно, принимает ли человек синтетические или натуральные препараты. Опасность гормонов – в далеко идущих последствиях. На генетическом уровне происходят деструктивные изменения, которые сказываются не только на детях людей, принимающих гормональные препараты, но и на их внуках. В гормонах заложена «мина замедленного действия», которая может «взорваться» через несколько поколений. Но в настоящее время наука не стоит на месте, поэтому в ближайшее время ученые, возможно, предложат нам новые методики «избегания катастрофы», вызванной приемом гормональных препаратов. Что ж, остается надеяться на науку и ждать нового фармакологического прорыва. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Наверх |
||||
|
|
||||
